Das Darmmikrobiom im gesunden und kranken Zustand

Dank neuer Befunde und verbesserter analytischer Verfahren stehen immer mehr Informationen zu unserem Darmmikrobiom zur Verfügung. Es wird deutlich, dass die Art und relative Anzahl der Bakterien, die in unserem Darm vorkommen, eine Schlüsselrolle bei Gesundheit und Krankheit spielen.
Biotechnologieunternehmen investieren immer mehr in Technologien, um dieses „Mikrobiom“ als potenziellen Moderator für unsere Darmgesundheit und unser angeborenes Immunsystem zu untersuchen. Die Zunahme von immunvermittelten Erkrankungen und neurologischen Störungen lässt sich nicht durch Veränderungen in der Humangenetik erklären. [1] Da wir unser „anderes Erbgut“ ins Visier nehmen, zeigt sich, dass diese Krankheiten im Allgemeinen auf eine Dysbiose (bakterielle Fehlbesiedelung) und einen Verlust von Diversität zurückgeführt werden können. Die bisher im Bereich der Metagenomik ausgeführten Arbeiten haben anschaulich verdeutlicht, dass eine größere bakterielle Diversität oder „Genvielfalt“ mit einer besseren Gesundheit im Zusammenhang steht.
INFO Schlüsseldefinitionen
- Mikrobiom: Der Sammelname für die Mikroorganismen des Darms.
- Dysbiose: Ein oder mehrere potenziell gefährliche mikrobielle Organismen, die in der mikrobiellen Darmpopulation überwiegen. [3]
- Metagenomik: Der Studienbereich, der ganze Genome miteinander vergleicht.
- Phyla: Ein taxonomischer Begriff, um Organismen mit anderen, die ähnliche Eigenschaften aufweisen, in Gruppen einzuteilen.
- Enterotyp: Ein Begriff, um Menschen in Gruppen einzuteilen, die auf den vorhandenen Darmbakterien basieren.
- Transkriptom: Die Gene, die als Proteine exprimiert wurden, z. B. der aktive Teil des Genoms.
Aus welcher Spezies ist das Mikrobiom beschaffen?
Obgleich größere inter-individuelle Variationen bezüglich der Spezies bestehen, beherbergen die meisten Menschen um die 160 Spezies von möglichen 1000 – die Phyla, die in dem Mikrobiom vorkommen, sind ziemlich begrenzt. Qin et al. (2010) haben einen Hauptkern von Bakterien ermittelt, die alle Menschen in sich tragen. Drei Enterotypen wurden für das menschliche Mikrobiom gebildet. [2] Die Gattungen, die bestimmen, zu welchem Mikrobiom ein Subjekt gehört, sind Bacteroides, Prevotella und Ruminococcus (die letztere Gruppe ist zusätzlich mit dem Vorkommen von Methanobrevibacter verbunden). [1]
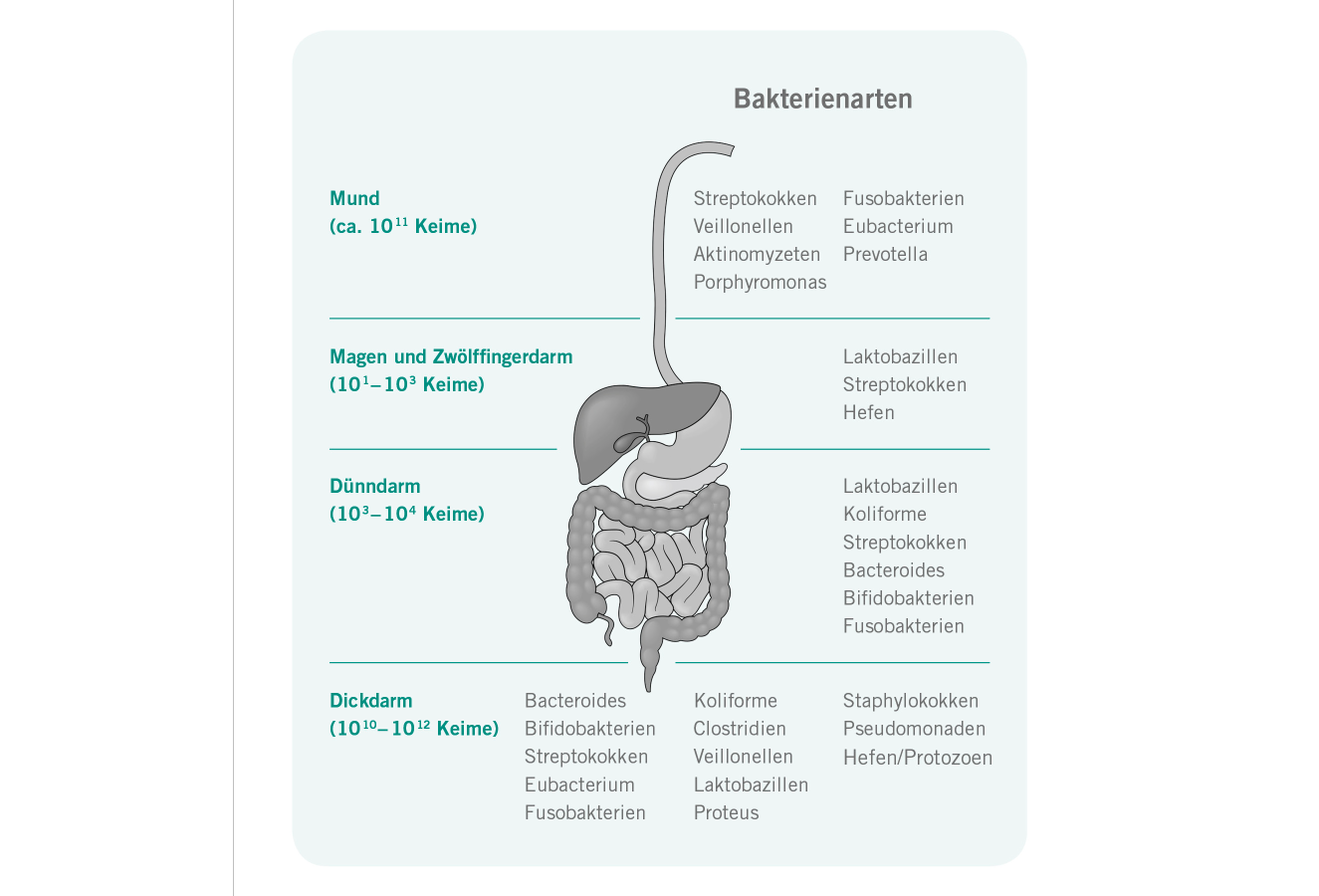
Funktion
Die Funktionen des Mikrobioms sind noch nicht vollständig entschlüsselt, aber einige Hauptmerkmale sind bereits ersichtlich:
Je nach dem fermentierten Substrat enthalten weitere Produkte des Mikrobioms die Gase Wasserstoff, Kohlenstoffdioxid und Methan sowie Ammoniak, Amine und Phenolverbindungen. [3]
Die Symbiose zwischen dem Menschen und dem Darmmikrobiom tritt immer deutlicher hervor. Der Begriff „Superorganismus“ wurde geprägt, als der menschliche Körper zunehmend als ein zusammengesetzter Organismus unseres eigenen Transkriptoms zusammen mit dem formbaren und weitaus größeren Transkriptom der Darmmikrobiota betrachtet wurde. Die von unserem Darmmikrobiom entschlüsselten Gene übertreffen unsere eigenen um ein Hundertfaches. [4] Es ist daher nicht überraschend, dass der Schwerpunkt im Bereich der Erforschung, Vorbeugung und Heilung von Krankheiten auf diesem „anderen Genom“ liegt.
Das enterische Nervensytem (ENS) wird in der Literatur manchmal als das „zweite Gehirn“ bezeichnet. Das hängt damit zusammen, das es aus über 200 Millionen Neuronen besteht. [5] Das ENS sendet Signale vom Darm zum Gehirn über endokrine, neuronale und immunologische afferente Signalwege. [5] Des Weiteren gilt das darmassoziierte lymphatische Gewebe (darmassoziierte Immunsystem) oder GALT (gut associated lymphoid tissue), das regelmäßig auf Signale aus dem Darmlumen reagiert, als das wichtigste Defensivorgan des Körpers gegen Infektionen. [5]
Die Kombination von Interaktionen zwischen ENS, Mikrobiom und GALT besitzt ein großes Potenzial, Änderungen zum physischen, immunologischen und emotionalen Wohlbefinden herbeizuführen.
- Immunsignalling und Immunmodulation
- Produktion von Neurotransmittern
- Produktion lebenswichtiger Vitamine
- Regulation des Fettstoffwechsels
- Produktion von kurzkettigen Fettsäuren, insbesondere Butyrat, und von verzweigtkettigen Fettsäuren
Je nach dem fermentierten Substrat enthalten weitere Produkte des Mikrobioms die Gase Wasserstoff, Kohlenstoffdioxid und Methan sowie Ammoniak, Amine und Phenolverbindungen. [3]
Die Symbiose zwischen dem Menschen und dem Darmmikrobiom tritt immer deutlicher hervor. Der Begriff „Superorganismus“ wurde geprägt, als der menschliche Körper zunehmend als ein zusammengesetzter Organismus unseres eigenen Transkriptoms zusammen mit dem formbaren und weitaus größeren Transkriptom der Darmmikrobiota betrachtet wurde. Die von unserem Darmmikrobiom entschlüsselten Gene übertreffen unsere eigenen um ein Hundertfaches. [4] Es ist daher nicht überraschend, dass der Schwerpunkt im Bereich der Erforschung, Vorbeugung und Heilung von Krankheiten auf diesem „anderen Genom“ liegt.
Das enterische Nervensytem (ENS) wird in der Literatur manchmal als das „zweite Gehirn“ bezeichnet. Das hängt damit zusammen, das es aus über 200 Millionen Neuronen besteht. [5] Das ENS sendet Signale vom Darm zum Gehirn über endokrine, neuronale und immunologische afferente Signalwege. [5] Des Weiteren gilt das darmassoziierte lymphatische Gewebe (darmassoziierte Immunsystem) oder GALT (gut associated lymphoid tissue), das regelmäßig auf Signale aus dem Darmlumen reagiert, als das wichtigste Defensivorgan des Körpers gegen Infektionen. [5]
Die Kombination von Interaktionen zwischen ENS, Mikrobiom und GALT besitzt ein großes Potenzial, Änderungen zum physischen, immunologischen und emotionalen Wohlbefinden herbeizuführen.
Was formt das Mikrobiom?
Das Mikrobiom entwickelt sich von Geburt an. Die Art der Geburt und frühe Fütterung beeinflussen die anfängliche Entwicklung des Mikrobioms. Abstillen und das kindliche Umfeld (auf dem Land oder in der Stadt) wirken sich wahrscheinlich ebenfalls auf die Entwicklung des reifen Mikrobioms aus. Untersuchungen von isolierten Bevölkerungsgruppen in Afrika zeigen eine abweichende und einzige bakterielle Kolonisation im Vergleich zu einer westlichen Kohorte und demonstrieren somit, dass die Umgebung eine treibende Kraft für die Kolonisation darstellt. [6] Untersuchungen von Zwillingen haben des Weiteren offengelegt, dass zumindest mit einigen Taxa ein eindeutiger genetischer Einfluss auf die Artenvielfalt besteht. [7] Die Partner von eineiigen Zwillingen wiesen ebenfalls positive Korrelationen auf, was die Vorstellung verfestigt, dass sowohl die Natur als auch die Ernährung die Genvielfalt des Darmmikrobioms beeinflussen können. [8]
Im Alter ändert sich das Mikrobiom erneut, obwohl die Gründe hierfür nicht bekannt sind. Bei der älteren Bevölkerung lassen sich eine Reduzierung des Butyrats, das Bakterien produziert, sowie eine Reduzierung der Genvielfalt des Mikrobioms feststellen. Ältere Menschen, die in einer Gemeinschaft leben, bewahren eine größere Genvielfalt, wahrscheinlich das Ergebnis einer abwechslungsreicheren Ernährung, als ältere Menschen in Langzeitpflege. [9]
Im Alter ändert sich das Mikrobiom erneut, obwohl die Gründe hierfür nicht bekannt sind. Bei der älteren Bevölkerung lassen sich eine Reduzierung des Butyrats, das Bakterien produziert, sowie eine Reduzierung der Genvielfalt des Mikrobioms feststellen. Ältere Menschen, die in einer Gemeinschaft leben, bewahren eine größere Genvielfalt, wahrscheinlich das Ergebnis einer abwechslungsreicheren Ernährung, als ältere Menschen in Langzeitpflege. [9]
Wie beeinflussen uns Änderungen?
Die Dysbiose wird mit verschiedenen Krankheitszuständen in Verbindung gebracht. [3] Ein aktueller Artikel behandelt die speziellen Krankheiten und die damit verbundenen Alterationen in Bakterienpopulationen. [4] Neue Technologien haben es ermöglicht, für einige Krankheiten eine Art bakteriellen Fingerabdruck zu entwickeln, der sowohl ein wirkungsvolles, nichtinvasives Diagnostikinstrument als auch ein potenzielles Ziel für die Therapie zur Behandlung dieser Krankheiten darstellt.
In Studien zu Übergewicht zeigten Personen mit reduzierter Genvielfalt eine stärkere Gesamtadipositas, Insulinresistenz und Dyslipidämie sowie einen ausgeprägten entzündlichen Phänotyp. [10] Die Personen mit geringerer Genvielfalt legten mit der Zeit auch mehr an Gewicht zu. Goodrich et al. (2014) vermittelten einen Einblick in die Heritabilität eines zu Adipositas neigenden Mikrobioms und des potenziellen Einflusses von Methanbildnern und der Spezies Christensenellaceae auf Stoffwechselkrankheiten.
Untersuchungen von Kindern mit genetischer Veranlagung zur Zöliakie zeigen eine Reduzierung von Actinobacteria (darunter Bifidobacteria) und eine Erhöhung der Spezies Firmicutes und Proteobacteria. [11] Eine eindeutige Verbindung zwischen mikrobiellen Alterationen und der Entwicklung der Zöliakie wurde jedoch nicht nachgewiesen. [12]
Dysbiose wurde durch die Sequenzierung des Mikrobioms beim Reizdarmsyndrom identifiziert. [13] Weitere Studien haben deutliche Unterschiede des Mikrobioms bei den verschiedenen Subtypen des Reizdarmsyndroms festgestellt, sowohl bei den luminalen als auch mukosalen Populationen. [14-16] Eine aktuelle Pilotstudie im Bereich der Kinderheilkunde kam zu dem Ergebnis, dass das Mikrobiom auf die Wirksamkeit einer FODMAP-armen Ernährung zur Symptomlinderung hinweisen kann. [17]
Qin et al. (2012) ermittelten ein antagonistisches Verhalten zwischen nützlichen und gefährlichen Bakterien bei Diabetes Typ 2. Ein Rückgang von Butyrate, das Bakterien produziert, kann ein Hinweis auf ein erhöhtes Risiko sein, mit Übergewicht verbundene Begleiterkrankungen zu entwickeln. [18]
In Studien zu Übergewicht zeigten Personen mit reduzierter Genvielfalt eine stärkere Gesamtadipositas, Insulinresistenz und Dyslipidämie sowie einen ausgeprägten entzündlichen Phänotyp. [10] Die Personen mit geringerer Genvielfalt legten mit der Zeit auch mehr an Gewicht zu. Goodrich et al. (2014) vermittelten einen Einblick in die Heritabilität eines zu Adipositas neigenden Mikrobioms und des potenziellen Einflusses von Methanbildnern und der Spezies Christensenellaceae auf Stoffwechselkrankheiten.
Untersuchungen von Kindern mit genetischer Veranlagung zur Zöliakie zeigen eine Reduzierung von Actinobacteria (darunter Bifidobacteria) und eine Erhöhung der Spezies Firmicutes und Proteobacteria. [11] Eine eindeutige Verbindung zwischen mikrobiellen Alterationen und der Entwicklung der Zöliakie wurde jedoch nicht nachgewiesen. [12]
Dysbiose wurde durch die Sequenzierung des Mikrobioms beim Reizdarmsyndrom identifiziert. [13] Weitere Studien haben deutliche Unterschiede des Mikrobioms bei den verschiedenen Subtypen des Reizdarmsyndroms festgestellt, sowohl bei den luminalen als auch mukosalen Populationen. [14-16] Eine aktuelle Pilotstudie im Bereich der Kinderheilkunde kam zu dem Ergebnis, dass das Mikrobiom auf die Wirksamkeit einer FODMAP-armen Ernährung zur Symptomlinderung hinweisen kann. [17]
Qin et al. (2012) ermittelten ein antagonistisches Verhalten zwischen nützlichen und gefährlichen Bakterien bei Diabetes Typ 2. Ein Rückgang von Butyrate, das Bakterien produziert, kann ein Hinweis auf ein erhöhtes Risiko sein, mit Übergewicht verbundene Begleiterkrankungen zu entwickeln. [18]
Wie können wir das Mikrobiom verbessern?
Ernährungsstudien haben gezeigt, inwieweit Veränderungen der Ernährung effizient zur Änderung des Mikrobioms eingesetzt werden können, [19] und dass dies folglich ein Bereich mit großem Potenzial ist. Die Ernährung des Wirts und die Ernährung des Mikrobioms stellen eine Möglichkeit dar, mittels der die Manipulation des Mikrobioms erfolgt. Eine fett- und proteinreiche Ernährung wurde mit dem Bacteroides-Enterotyp in Verbindung gebracht, eine kohlenhydratreiche Ernährung entspricht dagegen dem Prevotella-Enterotyp. [20] Es wurde aufgezeigt, dass kurzfristige Ernährungsumstellungen (~10 Tage) die Zusammensetzung des Mikrobioms ändern, aber die Identität des Enterotypen nicht nachhaltig beeinflussen. Zudem wurde nachgewiesen, dass sich Faecalibacterium prausnitzii, Bifidobacterium und Clostridium Cluster XIVa durch ballaststoffreiche Nahrungsergänzungsmittel erhöhen und es sich dabei um die drei Gruppen handelt, die im Allgemeinen mit einem besseren Gesundheitszustand assoziiert werden. [1,21]
Andere Studien haben eindeutig gezeigt, dass Präbiotika und Probiotika in unterschiedlichem Maße vorteilhafte Instrumente zur Förderung nützlicher Bifidobakterien und Laktobazillen sind. Mehrere Studien haben die Mechanismen dargelegt, mittels der sich verschiedene Arten von Laktobacillus und Bifidobacterium nicht nur günstig für den Wirt auswirken, sondern auch das Anheften und Eindringen enteropathogener Bakterien verhindern. [4] Es ist möglich, dass in Zukunft noch mehr Bakterienstämme (z. B. Akkermansia mucinophila und Christensenella minuta) durch die Supplementation mit Präbiotika und Probiotika ins Visier genommen werden. [4]
Die Stuhltransplantation ist ein weiteres Verfahren für die schnelle Korrektur eines gestörten Mikrobioms. Versuche bei Patienten mit therapierefraktärer Clostridium-difficile-Infektion haben bisher zu vielversprechenden Ergebnissen geführt. Die Stuhltransplantation von einem schlanken Spender hat zu einer Verbesserung der Insulinempfindlichkeit bei Patienten mit metabolischem Syndrom geführt [22] und stützt die wachsende Vorstellung, dass Dysbiose eine wichtige Rolle bei der Entwicklung von Krankheiten spielt, die im Zusammenhang mit Übergewicht stehen.
Antimikrobielle Strategien für die Modulation des Mikrobioms können vielleicht in Zukunft ein therapeutisches Potenzial besitzen. Aktuelles Wissen über die Wirksamkeit in diesem Bereich basiert auf Mausmodellen und stellt folglich derzeit keine empfehlenswerte Strategie dar. [4]
Eine ausgewogene Ernährung, die alle Lebensmittelgruppen einbezieht, sollte verfolgt werden, um ein abwechslungsreiches Substrat zu liefern und dem Auftreten von schädlichen Arten vorzubeugen, die im Darm überhandnehmen könnten. Bei Störungen des Mikrobioms, verursacht durch Antibiotika oder eine Gastroenteritis, empfiehlt sich der Einsatz von Präbiotika und Probiotika, die auch für die allgemeine Verwendung als sicher gelten. Stuhldiagnostik, die eine reduzierte Diversität ermittelt, kann ein nützliches Instrument für eine frühe Krankheitsprognose und Vorbeugemaßnahmen sein.
Andere Studien haben eindeutig gezeigt, dass Präbiotika und Probiotika in unterschiedlichem Maße vorteilhafte Instrumente zur Förderung nützlicher Bifidobakterien und Laktobazillen sind. Mehrere Studien haben die Mechanismen dargelegt, mittels der sich verschiedene Arten von Laktobacillus und Bifidobacterium nicht nur günstig für den Wirt auswirken, sondern auch das Anheften und Eindringen enteropathogener Bakterien verhindern. [4] Es ist möglich, dass in Zukunft noch mehr Bakterienstämme (z. B. Akkermansia mucinophila und Christensenella minuta) durch die Supplementation mit Präbiotika und Probiotika ins Visier genommen werden. [4]
Die Stuhltransplantation ist ein weiteres Verfahren für die schnelle Korrektur eines gestörten Mikrobioms. Versuche bei Patienten mit therapierefraktärer Clostridium-difficile-Infektion haben bisher zu vielversprechenden Ergebnissen geführt. Die Stuhltransplantation von einem schlanken Spender hat zu einer Verbesserung der Insulinempfindlichkeit bei Patienten mit metabolischem Syndrom geführt [22] und stützt die wachsende Vorstellung, dass Dysbiose eine wichtige Rolle bei der Entwicklung von Krankheiten spielt, die im Zusammenhang mit Übergewicht stehen.
Antimikrobielle Strategien für die Modulation des Mikrobioms können vielleicht in Zukunft ein therapeutisches Potenzial besitzen. Aktuelles Wissen über die Wirksamkeit in diesem Bereich basiert auf Mausmodellen und stellt folglich derzeit keine empfehlenswerte Strategie dar. [4]
Eine ausgewogene Ernährung, die alle Lebensmittelgruppen einbezieht, sollte verfolgt werden, um ein abwechslungsreiches Substrat zu liefern und dem Auftreten von schädlichen Arten vorzubeugen, die im Darm überhandnehmen könnten. Bei Störungen des Mikrobioms, verursacht durch Antibiotika oder eine Gastroenteritis, empfiehlt sich der Einsatz von Präbiotika und Probiotika, die auch für die allgemeine Verwendung als sicher gelten. Stuhldiagnostik, die eine reduzierte Diversität ermittelt, kann ein nützliches Instrument für eine frühe Krankheitsprognose und Vorbeugemaßnahmen sein.
Autor
BRIDGETTE WILSON BSC, MSC, PGDIP, RD.
ist Doktorandin am King’s College in London und staatlich anerkannte Diätassistentin. Derzeit arbeitet sie in einem Team unter der Leitung von Professor Kevin Whelan und Dr. Miranda Lomer am King’s College in London und erforscht Ernährungsmaßnahmen bei Reizdarmsyndrom.
ist Doktorandin am King’s College in London und staatlich anerkannte Diätassistentin. Derzeit arbeitet sie in einem Team unter der Leitung von Professor Kevin Whelan und Dr. Miranda Lomer am King’s College in London und erforscht Ernährungsmaßnahmen bei Reizdarmsyndrom.
Quellen
- Blottiere, H.M., et al., Human intestinal metagenomics: state of the art and future. Curr Opin Microbiol, 2013. 16(3): p. 232-9.
- Qin, J., et al., A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010. 464(7285): p. 59-65.
- Roberfroid, M., et al., Prebiotic effects: metabolic and health benefits. British Journal of Nutrition, 2010. 104(S2): p. S1-S63.
- Walsh, C.J., et al., Beneficial modulation of the gut microbiota. FEBS letters, 2014. 588(22): p. 4120-4130.
- Al Omran, Y. and Q. Aziz, The brain-gut axis in health and disease, in Microbial Endocrinology: The Microbiota-Gut-Brain Axis in Health and Disease. 2014, Springer. p. 135-153.
- De Filippo, C., et al., Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proceedings of the National Academy of Sciences, 2010. 107(33): p. 14691-14696.
- Goodrich, J.K., et al., Human genetics shape the gut microbiome. Cell, 2014. 159(4): p. 789-799.
- Nelson, K.E., et al., Metagenomics of the human body. 2011: Springer.
- Claesson, M.J., et al., Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proceedings of the National Academy of Sciences, 2011. 108(Supplement 1): p. 4586-4591.
- Le Chatelier, E., et al., Richness of human gut microbiome correlates with metabolic markers. Nature, 2013. 500(7464): p. 541-546.
- Olivares, M., et al., The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut, 2014: p. gutjnl-2014-306931.
- McLean, M.H., et al., Does the microbiota play a role in the pathogenesis of autoimmune diseases? Gut, 2014: p. gutjnl-2014-308514.
- Rajilic-Stojanovic, M., et al., Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology, 2011. 141(5): p. 1792-801.
- Saulnier, D.M., et al., The intestinal microbiome, probiotics and prebiotics in neurogastroenterology. Gut Microbes, 2013. 4(1): p. 17-27.
- Parkes, G.C., et al., Distinct microbial populations exist in the mucosa-associated microbiota of subgroups of irritable bowel syndrome. Neurogastroenterology & Motility, 2012. 24(1): p. 31-39.
- Sundin, J., et al., Altered faecal and mucosal microbial composition in post-infectious irritable bowel syndrome patients correlates with mucosal lymphocyte phenotypes and psychological distress. Aliment Pharmacol Ther, 2015. 41(4): p. 342-51.
- Chumpitazi, B.P., et al., Gut microbiota influences low fermentable substrate diet efficacy in children with irritable bowel syndrome. Gut microbes, 2014. 5(2): p. 165-175.
- Qin, J., et al., A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012. 490(7418): p. 55-60.
- Cotillard, A., et al., Dietary intervention impact on gut microbial gene richness. Nature, 2013. 500(7464): p. 585-8.
- Wu, G.D., et al., Linking long-term dietary patterns with gut microbial enterotypes. Science, 2011. 334(6052): p. 105-108.
- Shen, Q., L. Zhao, and K.M. Tuohy, High-level dietary fibre up-regulates colonic fermentation and relative abundance of saccharolytic bacteria within the human faecal microbiota in vitro. European journal of nutrition, 2012. 51(6): p. 693-705.
- Vrieze, A., et al., Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology, 2012. 143(4): p. 913-6.e7.
www.drschaer-institute.com
