Begleiterkrankungen der Zöliakie

Mit einer Prävalenz von 13,8 Prozent sind Autoimmunerkrankungen bei Zöliakiepatienten im Vergleich zu Nichtbetroffenen recht häufig anzutreffen. Aber auch mit Unverträglichkeiten sowie genetischen, endokrinologischen und neurologischen Erkrankungen ist die Zöliakie assoziiert.
Zöliakie geht oft mit Autoimmunerkrankungen einher und ist mit verschiedenen anderen Erkrankungen assoziiert. An erster Stelle ist bei den Autoimmunerkrankungen der Diabetes Typ 1 zu nennen. Daneben treten auch Schilddrüsen- und Lebererkrankungen vielfach in Kombination mit einer Zöliakie auf. Bei den assoziierten Erkrankungen ist beispielsweise die entzündliche Hauterkrankung Dermatitis herpetiformis Duhring zu nennen. Diese ist die sogenannte Hautmanifestation der Zöliakie. Vor der Diagnose und in der ersten Zeit danach kann bei Zöliakiebetroffenen eine sekundäre Laktoseintoleranz auftreten. Auch ein erhöhtes Osteoporoserisiko sowie Fertilitätsstörungen bei Zöliakiebetroffenen werden diskutiert.
Diabetes Typ 1
Zöliakie und Diabetes Typ 1 treten oft gemeinsam auf. Die Prävalenz der Zöliakie bei Typ-1-Diabetikern liegt je nach Alter der Patienten zwischen drei und acht Prozent. Auch bei Verwandten ersten Grades eines Diabetikers tritt Zöliakie häufig auf. Umgekehrt haben drei bis sechs Prozent der Zöliakiebetroffenen Diabetes Typ 1.
Genetische Gemeinsamkeiten
Das gemeinsame Auftreten der beiden Erkrankungen scheint durch eine gemeinsame genetische Prädisposition verursacht zu sein, denn sowohl bei Diabetes als auch bei Zöliakie lässt sich eine erhöhte Frequenz der sogenannten Histokompatibilitätsgene HLA-DQ2 und HLA-DQ8 feststellen. Außerdem wurden sowohl bei Typ-1-Diabetikern als auch bei Zöliakiepatienten erhöhte Zonulinspiegel festgestellt. Zonulin ist ein Protein, das die Darmpermeabilität im Bereich des Dünndarms regelt.
Diabetesdiagnose
In den meisten Fällen (circa 90 Prozent) wird zuerst der Diabetes Typ 1 diagnostiziert. Dies ist wahrscheinlich auf die geringe Symptomatik der Zöliakie bei den betroffenen Patienten im Kindes- und Jugendalter zurückzuführen. Menschen, bei denen eine Zöliakie nicht rechtzeitig diagnostiziert wurde und deren Ernährung lange Zeit glutenhaltige Produkte enthielt, weisen ein höheres Risiko auf, an Diabetes zu erkranken.
Ernährungsempfehlungen
Um beide Krankheiten zu behandeln, muss eine streng glutenfreie Ernährung eingehalten werden, aber keine bestimmte Diabetikerkost. Diabetikern, ob mit oder ohne Zöliakie, empfiehlt sich heute eine normale, ausgewogene Ernährung. Die glutenfreie Ernährung hat auch positive Auswirkungen auf den Diabetes, da der Stoffwechsel besser kontrolliert wird und dadurch eventuell der Insulinbedarf gesenkt werden kann.
Zöliakiescreening bei Typ-1-Diabetikern
Angesichts der häufigen Assoziation der beiden Pathologien sollten alle Typ-1-Diabetiker einem Zöliakiescreening unterzogen werden, bei dem die tTg-IgA-Antikörper bestimmt werden:
Genetische Gemeinsamkeiten
Das gemeinsame Auftreten der beiden Erkrankungen scheint durch eine gemeinsame genetische Prädisposition verursacht zu sein, denn sowohl bei Diabetes als auch bei Zöliakie lässt sich eine erhöhte Frequenz der sogenannten Histokompatibilitätsgene HLA-DQ2 und HLA-DQ8 feststellen. Außerdem wurden sowohl bei Typ-1-Diabetikern als auch bei Zöliakiepatienten erhöhte Zonulinspiegel festgestellt. Zonulin ist ein Protein, das die Darmpermeabilität im Bereich des Dünndarms regelt.
Diabetesdiagnose
In den meisten Fällen (circa 90 Prozent) wird zuerst der Diabetes Typ 1 diagnostiziert. Dies ist wahrscheinlich auf die geringe Symptomatik der Zöliakie bei den betroffenen Patienten im Kindes- und Jugendalter zurückzuführen. Menschen, bei denen eine Zöliakie nicht rechtzeitig diagnostiziert wurde und deren Ernährung lange Zeit glutenhaltige Produkte enthielt, weisen ein höheres Risiko auf, an Diabetes zu erkranken.
Ernährungsempfehlungen
Um beide Krankheiten zu behandeln, muss eine streng glutenfreie Ernährung eingehalten werden, aber keine bestimmte Diabetikerkost. Diabetikern, ob mit oder ohne Zöliakie, empfiehlt sich heute eine normale, ausgewogene Ernährung. Die glutenfreie Ernährung hat auch positive Auswirkungen auf den Diabetes, da der Stoffwechsel besser kontrolliert wird und dadurch eventuell der Insulinbedarf gesenkt werden kann.
Zöliakiescreening bei Typ-1-Diabetikern
Angesichts der häufigen Assoziation der beiden Pathologien sollten alle Typ-1-Diabetiker einem Zöliakiescreening unterzogen werden, bei dem die tTg-IgA-Antikörper bestimmt werden:
- zum Zeitpunkt der Diabetesdiagnose
- drei Jahre lang einmal jährlich
- im fünften Jahr nach der Diabetesdiagnose
- bei verdächtigen Symptomen
Hashimoto Thyreoiditis
Neben Diabetes Typ 1 sind autoimmune Schilddrüsenerkrankungen, vor allem die Hashimoto Thyreoiditis, mit einer Prävalenz von drei bis zehn Prozent überproportional häufig mit Zöliakie assoziiert. Besonders bei Patienten, die bei der Erstdiagnose älter sind. Die Autoimmunthyreoiditis ist die häufigste Ursache einer Hypothyreose im Erwachsenenalter. Sie geht mit einer partiellen oder vollständigen Zerstörung des Schilddrüsengewebes einher, das unter anderem von Auto-Antikörpern angegriffen wird.
Schilddrüsenerkrankungen rechtzeitig erkennen
Da ein Screening relativ leicht durchzuführen ist und sich Schilddrüsenerkrankungen möglicherweise nicht mit eindeutigen Symptomen manifestieren, sollten Zöliakiepatienten das thyreoidstimulierende Hormon (TSH) zum Zeitpunkt der Zöliakiediagnose und danach regelmäßig im Abstand von einigen Jahren überprüfen lassen. Auch für Angehörige ersten Grades von Personen mit Zöliakie oder autoimmunen Schilddrüsenerkrankungen ist dies empfehlenswert.
Therapie bei Zöliakiepatienten
Besteht bereits eine funktionelle Hypothyreose kann eine Behandlung mit LT4-Präparaten indiziert sein. Bei neudiagnostizierten Zöliakiepatienten kann aufgrund der Zottenatrophie die LT4-Aufnahme und die Resorption aller anderen notwendigen Medikamente erheblich vermindert sein. Eine Dosisanpassung ist daher unbedingt zu erwägen. Unter strikter glutenfreier Diät kann sich die Dünndarmschleimhaut wieder vollständig regenerieren, sodass die benötigten Dosen entsprechend wieder reduziert werden können.
Schilddrüsenerkrankungen rechtzeitig erkennen
Da ein Screening relativ leicht durchzuführen ist und sich Schilddrüsenerkrankungen möglicherweise nicht mit eindeutigen Symptomen manifestieren, sollten Zöliakiepatienten das thyreoidstimulierende Hormon (TSH) zum Zeitpunkt der Zöliakiediagnose und danach regelmäßig im Abstand von einigen Jahren überprüfen lassen. Auch für Angehörige ersten Grades von Personen mit Zöliakie oder autoimmunen Schilddrüsenerkrankungen ist dies empfehlenswert.
Therapie bei Zöliakiepatienten
Besteht bereits eine funktionelle Hypothyreose kann eine Behandlung mit LT4-Präparaten indiziert sein. Bei neudiagnostizierten Zöliakiepatienten kann aufgrund der Zottenatrophie die LT4-Aufnahme und die Resorption aller anderen notwendigen Medikamente erheblich vermindert sein. Eine Dosisanpassung ist daher unbedingt zu erwägen. Unter strikter glutenfreier Diät kann sich die Dünndarmschleimhaut wieder vollständig regenerieren, sodass die benötigten Dosen entsprechend wieder reduziert werden können.
Autoimmunhepatitis
Die Autoimmunhepatitis ist eine seltene, akute oder chronisch-entzündliche Autoimmunkrankheit der Leber. Das eigene Immunsystem greift hierbei Leberzellen an, wodurch es zur Leberentzündung (Hepatitis) kommt. Aufgrund des gemeinsamen genetischen Hintergrunds tritt eine Autoimmunhepatitis häufig in Kombination mit einer Zöliakie auf. Dabei ist die Assoziation zwischen diesen beiden Autoimmunerkrankungen umso höher, je älter der Patient bei der Zöliakiediagnose ist. Bei 30 Prozent der Patienten über 20 Jahre zeigt sich bereits eine weitere Autoimmunkrankheit.
Lebererkrankungen rechtzeitig erkennen
Da ein Screening relativ leicht durchzuführen ist und sich Lebererkrankungen möglicherweise nicht mit eindeutigen Symptomen manifestieren, sollten Zöliakiepatienten zum Zeitpunkt der Zöliakiediagnose und danach regelmäßig im Abstand von einigen Jahren Leberfunktionstests durchführen lassen.
Lebererkrankungen rechtzeitig erkennen
Da ein Screening relativ leicht durchzuführen ist und sich Lebererkrankungen möglicherweise nicht mit eindeutigen Symptomen manifestieren, sollten Zöliakiepatienten zum Zeitpunkt der Zöliakiediagnose und danach regelmäßig im Abstand von einigen Jahren Leberfunktionstests durchführen lassen.
Laktoseintoleranz
Aufgrund der Zottenatrophie kann bei Zöliakiebetroffenen vor der Diagnose und in der ersten Zeit danach eine sekundäre Laktoseintoleranz auftreten. Die Schädigung der Dünndarmschleimhaut kann einen Laktasemangel in unterschiedlicher Ausprägung verursachen, sodass das Disaccharid Laktose nicht mehr vollständig hydrolisiert und absorbiert wird. Deshalb sollten sich diese Patienten zu Beginn nicht nur glutenfrei, sondern auch laktosefrei ernähren. In der Remissionsphase kann der Betroffene in der Regel Laktose wieder vertragen.
Dauerhafter Laktasemangel
In manchen Fällen kann die Laktoseintoleranz (Milchzuckerunverträglichkeit) auch nach Beginn der glutenfreien Ernährung und trotz regenerierter Dünndarmschleimhaut immer noch vorhanden sein. Dies ist auf einen genetischen Enzymmangel zurückzuführen, der generell bei der südeuropäischen Bevölkerung häufig auftritt, nicht jedoch durch Zöliakie ausgelöst wird. In Deutschland geht man davon aus, dass circa 15 Prozent der Bevölkerung eine Laktoseintoleranz hat.
Dauerhafter Laktasemangel
In manchen Fällen kann die Laktoseintoleranz (Milchzuckerunverträglichkeit) auch nach Beginn der glutenfreien Ernährung und trotz regenerierter Dünndarmschleimhaut immer noch vorhanden sein. Dies ist auf einen genetischen Enzymmangel zurückzuführen, der generell bei der südeuropäischen Bevölkerung häufig auftritt, nicht jedoch durch Zöliakie ausgelöst wird. In Deutschland geht man davon aus, dass circa 15 Prozent der Bevölkerung eine Laktoseintoleranz hat.
Dermatitis herpetiformis Duhring
Die Dermatitis herpetiformis Duhring (DH) ist eine entzündliche Hauterkrankung, bei der ein stark juckender Hautausschlag mit Papeln auftritt, die meist eine Rotfärbung aufweisen. Wegen des starken Juckreizes kratzen sich die Betroffenen oft auf, sodass ein Wundschorf zurückbleibt. Bei 90 Prozent der Patienten zeigt sich der Ausschlag an Ellbogen und Unterarmen. Andere häufig befallene Stellen sind das Gesäß und die Vorderseite der Knie. Die DH kommt praktisch nur bei Menschen mit heller Haut vor. Die Inzidenz liegt bei rund 1 : 10.000.
Zusammenhang mit Zöliakie
Die Dermatitis herpetiformis Duhring (DH) gilt als Hautmanifestation der Zöliakie. Wird bei einem Patienten DH diagnostiziert, liegt automatisch auch eine Zöliakie vor. Umgekehrt ist dies jedoch nicht zwangsläufig der Fall. Bei vielen DH-Patienten ist die Zöliakie jedoch nur schwach ausgeprägt und wird meist gar nicht bemerkt, bis der typische Hautausschlag auftritt. Diagnostiziert wird die DH mittels eines Hauttests und der klassischen Zöliakiediagnostik (Antikörpertest plus Dünndarmbiopsie).
Genetische Ursachen
Die Krankheit wurde erstmals 1884 als klinische Entität beschrieben und nach ihrem Entdecker L. A. Duhring benannt. Dass es einen Zusammenhang der Dermatitis herpetiformis Duhring (DH) mit Zöliakie gibt, stellte man jedoch erst Ende der 1960er Jahre fest. In Familienstudien wurde festgestellt, dass Familienangehörige von DH-Betroffenen oft auch eine DH entwickeln oder an Zöliakie leiden. Untersuchungen haben gezeigt, dass bei beiden Erkrankungen dieselben Gene involviert sind. Unser Körper verfügt über sogenannte HLA-Antigene, welche die Immunreaktion steuern. Bei einer DH oder Zöliakie liegen die HLA-Genotypen DR3-DQ2 und DR3-DQ8 vor. Diese Antigene sind Voraussetzung, um eine DH oder Zöliakie zu entwickeln.
Therapie der Dermatitis herpetiformis Duhring
Sowohl die Dermatitis herpetiformis Duhring (DH) als auch die Zöliakie werden durch die Aufnahme von Gluten verursacht. Daher stellt wie bei Zöliakie eine streng glutenfreie Ernährung die einzige effektive Behandlung der DH dar. Bei den meisten Patienten dauert es jedoch sehr lange, bis eine glutenfreie Ernährung die Symptome der DH zum Verschwinden bringt. Deshalb ist in der Zwischenzeit eine medikamentöse Behandlung erforderlich. Durch die Verabreichung der Medikamente verschwindet der Hautausschlag innerhalb einer Woche. Doch nur eine streng glutenfreie Ernährung lässt den Hautausschlag auch langfristig verschwinden. Bis die Medikamentendosis reduziert werden kann, dauert es etwa sechs bis acht Monate, nach zwei Jahren können die Medikamente meist ganz abgesetzt werden.
Zusammenhang mit Zöliakie
Die Dermatitis herpetiformis Duhring (DH) gilt als Hautmanifestation der Zöliakie. Wird bei einem Patienten DH diagnostiziert, liegt automatisch auch eine Zöliakie vor. Umgekehrt ist dies jedoch nicht zwangsläufig der Fall. Bei vielen DH-Patienten ist die Zöliakie jedoch nur schwach ausgeprägt und wird meist gar nicht bemerkt, bis der typische Hautausschlag auftritt. Diagnostiziert wird die DH mittels eines Hauttests und der klassischen Zöliakiediagnostik (Antikörpertest plus Dünndarmbiopsie).
Genetische Ursachen
Die Krankheit wurde erstmals 1884 als klinische Entität beschrieben und nach ihrem Entdecker L. A. Duhring benannt. Dass es einen Zusammenhang der Dermatitis herpetiformis Duhring (DH) mit Zöliakie gibt, stellte man jedoch erst Ende der 1960er Jahre fest. In Familienstudien wurde festgestellt, dass Familienangehörige von DH-Betroffenen oft auch eine DH entwickeln oder an Zöliakie leiden. Untersuchungen haben gezeigt, dass bei beiden Erkrankungen dieselben Gene involviert sind. Unser Körper verfügt über sogenannte HLA-Antigene, welche die Immunreaktion steuern. Bei einer DH oder Zöliakie liegen die HLA-Genotypen DR3-DQ2 und DR3-DQ8 vor. Diese Antigene sind Voraussetzung, um eine DH oder Zöliakie zu entwickeln.
Therapie der Dermatitis herpetiformis Duhring
Sowohl die Dermatitis herpetiformis Duhring (DH) als auch die Zöliakie werden durch die Aufnahme von Gluten verursacht. Daher stellt wie bei Zöliakie eine streng glutenfreie Ernährung die einzige effektive Behandlung der DH dar. Bei den meisten Patienten dauert es jedoch sehr lange, bis eine glutenfreie Ernährung die Symptome der DH zum Verschwinden bringt. Deshalb ist in der Zwischenzeit eine medikamentöse Behandlung erforderlich. Durch die Verabreichung der Medikamente verschwindet der Hautausschlag innerhalb einer Woche. Doch nur eine streng glutenfreie Ernährung lässt den Hautausschlag auch langfristig verschwinden. Bis die Medikamentendosis reduziert werden kann, dauert es etwa sechs bis acht Monate, nach zwei Jahren können die Medikamente meist ganz abgesetzt werden.
Osteoporose
In Studien wurde ein erhöhtes Frakturrisiko bei Menschen mit Zöliakie beobachtet. Doch dieses ist in der Mehrzahl der Fälle auf eine niedrige Knochenmineraldichte (KMD) zurückzuführen. Es gilt daher zu bedenken, dass sich das beobachtete erhöhte Frakturrisiko häufig auf Menschen mit einer unbehandelten Zöliakie bezieht, die sich also nicht streng an eine glutenfreie Ernährung halten. Zudem haben noch andere Faktoren Auswirkungen auf die KMD und folglich das Frakturrisiko. Die Bestimmung der KMD ist jedoch nur bei Patienten ratsam, die bereits glutenfrei leben und bei denen neben der Zöliakie weitere Risikofaktoren bekannt sind.
Fertilitätsstörungen
Eine unentdeckte bzw. unbehandelte Zöliakie kann bei Frauen zu Fertilitätsstörungen und Komplikationen in der Schwangerschaft führen, d. h. Infertilität, Früh- oder Fehlgeburten. Auch kann sie negative Auswirkungen auf das Geburtsgewicht der Neugeborenen haben. Ob diese alleine auf die Malabsorption bestimmter Nährstoffe aufgrund der Zottenatrophie zurückgeführt werden kann oder immunologische Faktoren dahinterstecken, ist nicht eindeutig geklärt.
Weitere Begleiterkrankungen
- Selektiver IgA-Mangel
- Sjörgen-Syndrom
- Primäre biliäre Zirrhose
- Morbus Crohn
- Down-Syndrom
- Ullrich-Turner-Syndrom
- Williams-Syndrom
- Epilepsie
Malignomentstehung
Das Risiko, einen bösartigen Tumor zu entwickeln, ist für Zöliakiepatienten generell nur leicht erhöht. Allerdings treten spezifische Malignome, z. B. im Bereich der Speiseröhre oder des Dünndarms, deutlich häufiger auf. Um dieses Risiko zu senken, ist die Einhaltung der glutenfreien Ernährung sehr wichtig, da diese vor zöliakie-assoziierten Malignomen schützen kann.
Quellen
- Malignomentstehung: Zöliakie – Grundlagen, Diagnostik, Ernährungstherapie, Ernährungs-Umschau 4/2011, S. 207
- Fertilität: Celiac disease and reproductive disorder, Hum. Reprod. Update, July/August 2014, Volume 20, Issue 4, S. 582-593
- http://de.statista.com/statistik/daten/studie/314821/umfrage/geschaetzte-haeufigkeit-von-lebensmittelunvertraeglichkeit-in-deutschland/ (13.05.2015)
Weiterführende Informationen
E-Learning
1
Alle anzeigen
Fachartikel
1
Alle anzeigen
Präsentationen
1
Alle anzeigen
Studien
7
Alle anzeigen

Modul 2 - Grundlagen der Zöliakie Teil 2
Aufgrund der häufig vielfältigen Beschwerden und verschiedenen Formen der Zöliakie ist diese oft schwierig zu diagnostizieren. Zunächst werden die einzelnen Schritte einer Zöliakiediagnose erläutert, bestehend aus Anamnese, Serologie und Histologie. Weiterhin werden assoziierte Erkrankungen aufgezählt und deren Verbindung mit Zöliakie erklärt. Im letzten Teil des Moduls wird auf Komplikationen hingewiesen, die in Zusammenhang mit Zöliakie auftreten und wie mit diesen umgegangen werden kann.
Die Lerninhalte wurden gemeinsam mit Prof. Dr. med. Wolfgang Holtmeier zusammengestellt.
Die Lerninhalte wurden gemeinsam mit Prof. Dr. med. Wolfgang Holtmeier zusammengestellt.

Modul 2 - Grundlagen der Zöliakie Teil 2
Aufgrund der häufig vielfältigen Beschwerden und verschiedenen Formen ...

Zöliakie und Typ-1-Diabetes mellitus
Zöliakie und Typ-1-Diabetes mellitus sind häufige Krankheitsbilder, die mit einer signifikanten Morbidität und Mortalität einhergehen. Dieser Artikel analysiert die Verbindung zwischen den beiden Erkrankungen und die Herausforderungen, mit denen Patienten und medizinisches Fachpersonal konfrontiert sind.
Zöliakie, eine chronisch entzündliche Erkrankung des Dünndarms, kann als Zustand einer verstärkten immunologischen Reaktion auf mit der Nahrung aufgenommenes Gluten (aus Weizen, Gerste oder Roggen) bei genetisch entsprechend veranlagten Menschen definiert werden. [1] Die Prävalenz dieser Erkrankung wird mittlerweile weithin auf rund ein Prozent geschätzt. [2] Wesentlich für die Behandlung von Zöliakie ist die lebenslange Einhaltung einer strikten glutenfreien Diät (GFD), die in der Mehrheit der Fälle zu besseren klinischen Ergebnissen, psychologischem Wohlbefinden und mehr Lebensqualität führt. [3, 4] Glykämische Kontrolle bei T1DM Autoimmunerkrankungen, wie Funktionsstörungen der Schilddrüse, Sjögren-Syndrom, Addison-Krankheit und Typ-1-Diabetes mellitus (T1DM), treten bei Patienten mit Zöliakie häufiger auf als in der allgemeinen Bevölkerung. T1DM ist eine Störung des Glukosestoffwechsels, die aus Insulinmangel als Folge einer Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse durch das körpereigene Immunsystem resultiert. Langfristige mikrovaskuläre und neurologische Komplikationen sind für eine höhere Morbidität und Mortalität bei T1DM verantwortlich. [5] Es hat sich gezeigt, dass eine intensive Blutzuckerkontrolle diese Komplikationen mindern und die Lebensqualität verbessern kann. [5, 6]
Allerdings erfordert eine solche glykämische Kontrolle eine komplexe lebenslange Diät- und Insulintherapie, obwohl diese potenzielle Beeinträchtigung bis zu einem gewissen Grad mithilfe des britischen Programms DAFNE (Dose Adjustment For Normal Eating) überwindbar ist. Es handelt sich hierbei um ein kontinuierliches Schulungsprogramm, das vorrangig von Diabetes- und Ernährungsberatern angeboten wird. DAFNE ermöglicht motivierten Patienten einen lockereren Umgang mit Diäteinschränkungen in Verbindung mit einer dynamischeren Insulintherapie.
Diabetes- vor Zöliakiediagnose
Der Zusammenhang zwischen Zöliakie und T1DM wurde vor mehr als 30 Jahren vor allem von Kinderärzten erkannt. Die Verbindung zwischen den zwei Erkrankungen wurde der Überlappung in den Prädispositionsgenen HLA-DQ2/DQ8 zugeschrieben, die Menschen für beide Störungen empfänglich macht. Es scheint klar zu sein, dass in der Mehrheit der Fälle T1DM ausnahmslos zuerst diagnostiziert wird. Dies kann daran liegen, dass T1DM im Allgemeinen akut einsetzt und die Symptome leichter zu erkennen sind. Darüber hinaus gibt es Hinweise dafür, dass zöliakiebetroffene Personen, die eine GFD einhalten, eine geringere Inzidenz anderer Autoimmunerkrankungen haben als Menschen, die eine solche Diät nicht befolgen. [7] Wenn diese Beobachtung stimmt, erklärt das auch, warum es so wenige Daten über die Entwicklung von T1DM nach einer Zöliakiediagnose gibt.
Prävalenz von Zöliakie und T1DM
Die Prävalenz von Zöliakie bei Kindern und Erwachsenen mit T1DM variiert je nach geografischer Lage, wobei Daten aus Großbritannien von 4,4 % [8] bzw. 3,3 % [9] ausgehen. Aktuelle NICE-Richtlinien (NICE = National Institute for Health and Clinical Excellence) empfehlen, dass T1DM-Patienten ein Zöliakietest vorgeschlagen werden soll – zum Zeitpunkt der Diagnose und später noch einmal, falls entsprechende Symptome auftreten. [10, 11] Zöliakie ist bei Frauen mit T1DM häufiger als bei Männern. Altersmäßig gesehen, tritt T1DM bei Patienten, die unter beiden Erkrankungen leiden, früher auf als bei jenen, die nur von T1DM betroff en sind. 12 Die gastrointestinalen Ausprägungen von Zöliakie sind bei T1DM nur selten festzustellen (in weniger als 10 % der Fälle), wobei die meisten Patienten entweder symptomfrei sind oder nur geringfügige Symptome haben. Patienten können zudem extraintestinale Symptome aufweisen, etwa Kleinwüchsigkeit, geringer BMI, verzögerte Pubertät oder Ernährungsmängel wie Eisenmangelanämie. [13, 14] Solche Komplikationen treten bei Kindern eher auf als bei Jugendlichen und Erwachsenen. 15 Einmal diagnostiziert, kann die Behandlung mit einer GFD helfen, diese Probleme zu lösen bzw. zu verhindern und zusätzlich zu einer Verringerung von Langzeitkomplikationen wie Osteoporose und bösartigen Tumoren beitragen.
Einhaltung der glutenfreien Diät
Dennoch kann eine GFD bei Patienten, die von beiden Erkrankungen betroffen sind, eine komplexe Angelegenheit sein. Die Einhaltung einer GFD funktioniert bei Patienten mit Zöliakiesymptomen am besten, während symptomfreie Patienten und Heranwachsende bzw. junge Erwachsene eine solche Diät mitunter sozial einschränkend finden, vor allem weil sie bereits mit einer komplexen chronischen Störung wie T1DM zu kämpfen haben. Unterstützung und feinfühlige Kommunikation seitens des medizinischen Fachpersonals und der Eltern gleichermaßen sind in solchen Fällen essenziell. [13]
Wirkung der GFD auf glykämische Kontrolle und Lebensqualität
Obwohl sich eine Vielzahl von Studien mit der Prävalenz von Zöliakie bei T1DM befasst, wurden andere wichtige klinische Faktoren bis dato nicht eingehend untersucht. Die wichtigsten Bereiche sind glykämische Kontrolle, Lebensqualität, mikrovaskuläre Komplikationen, kardiale Risikofaktoren und Knochendichte. Bisherige Untersuchungen zur Auswirkung von Zöliakie und einer GFD auf die glykämische Kontrolle brachten widersprüchliche Ergebnisse: Einige zeigten Verbesserungen [16], andere Verschlechterungen [17, 18], wieder andere überhaupt keine Auswirkungen [19]. Die Schwierigkeit bei der Auslegung dieser Studien ist, dass sich die meisten auf Kinder beziehen, klein, retrospektiv und unkontrolliert sind und diese wichtige Frage unbeantwortet lassen. Ebenso gab es bisher keine Bewertung der Lebensqualität vor und nach der Zöliakiediagnose bei erwachsenen Patienten mit T1DM, um die Auswirkungen der Diagnose und einer anschließenden GFD zu beurteilen. Der Versuch, sich zusätzlich zu den Einschränkungen einer Diabetesdiät an eine GFD zu halten, kann sich theoretisch negativ auf die Lebensqualität auswirken. Eine neuere Arbeit unserer Abteilung beschäftigt sich mit diesen Fragen. Wir konnten nachweisen, dass erwachsene T1DMPatienten mit neudiagnostizierter Zöliakie eine schlechtere glykämische Kontrolle (8,2 % versus 7,5 %, p = 0,05), ein niedrigeres Gesamtcholesterin (4,1 versus 4,9; p = 0,014), ein niedrigeres HDL-Cholesterin (1,1 versus 1,6; p = 0,017) sowie eine höhere Prävalenz von Retinopathie (58,3 % versus 25 %, p = 0,02), Nephropathie (45 % versus 5 %, p = 0,009) und peripherer Neuropathie (42,9 % versus 15 %; p = 0,11) haben. Nach einem Jahr GFD verbesserte sich insgesamt nur das Lipidprofil, wohingegen bei Personen, die sich streng an die Diät hielten, auch das HbA1c und die Nephropathie-Marker besser wurden. Darüber hinaus war die Behandlung mit einer GFD bei dieser Studie zuverlässig und es gab keinen Unterschied in Bezug auf die Lebensqualität (alle p > 0,1) nach einem Jahr GFD. Dies deutet darauf hin, dass sich eine GFD bei Patienten mit einer bereits komplexen Diabetesdiät nicht negativ auf die Lebensqualität auswirkt. 9 Allerdings war diese Studie klein dimensioniert (T1DM und Zöliakie: n = 12) und die Nachbetreuung endete nach einem Jahr.
Diabetische Retinopathie überwachen
Eine große schwedische bevölkerungsbasierte Kohortenstudie über das Risiko von diabetischer Retinopathie kam zu der Erkenntnis, dass die Dauer einer Zöliakie bei T1DM ein starker Indikator für die künftige Entwicklung einer diabetischen Retinopathie ist. 20 Im Vergleich zu Personen, die nur von T1DM betroffen sind, erhöht sich bei Menschen mit T1DM, die länger als zehn Jahre unter Zöliakie leiden, das Risiko, eine Retinopathie zu entwickeln, signifikant (um > 200 %, bereinigte Hazard-Ratio 3,01). Dies spricht für eine genauere Überwachung in Hinblick auf Retinopathie bei Patienten mit langjähriger Zöliakie und T1DM. [20]
Auswirkungen auf den Cholesterinspiegel
Neuere epidemiologische Studien legen überdies nahe, dass Zöliakiepatienten ein geringeres Risiko haben, ischämische Herzkrankheiten zu entwickeln, möglicherweise als Folge eines niedrigeren Cholesterinspiegels. [21] Eine andere Studie zeigte, dass bei neudiagnostizierter Zöliakie das Gesamtcholesterin zum Zeitpunkt der Diagnose und nach zwölf Monaten GFD geringer war und das HDLCholesterin trotz unveränderten Gesamtcholesterins um durchschnittlich 12 % anstieg. [22] Dies ist für Patienten mit erhöhtem kardialem Risiko und somit auch für T1DM-Patienten von besonderer Bedeutung.
T1DM und Knochenstoffwechsel
T1DM verursacht anerkanntermaßen einen veränderten Knochenstoff wechsel und eine veränderte Knochenstruktur, insbesondere in Zusammenhang mit der Dauer und einer schlechten Stoffwechseleinstellung des Diabetes. [23] Zöliakie selbst wird auch mit Osteopenie und Osteoporose in Zusammenhang gebracht. Der Knochenstoff wechsel bei Vorhandensein beider Störungen wurde kürzlich von einer italienischen Gruppe untersucht: Man fand heraus, dass die mittels Ultraschall gemessene phalangeale Knochenqualität bei Patienten mit T1DM und Zöliakie, die sich streng an eine GFD halten, ähnlich der von Patienten ist, die nur unter T1DM leiden (12,9 % vs. 8 %, p = 0,015). Eine höhere Prävalenz von Osteopenie ist bei Patienten mit beiden Erkrankungen gegeben, die berichteten, regelmäßig Diätsünden im Rahmen ihrer GFD zu begehen (45,5 %). [24] So lässt sich schlussfolgern, dass eine GFD und eine optimale glykämische Kontrolle eine wichtige Rolle bei der Prävention von Osteopenie als Folge des gleichzeitigen Auftretens dieser beiden chronischen Erkrankungen spielen. [24]
Fazit
Es ist wichtig, den Zusammenhang zwischen Zöliakie und T1DM zu erkennen. Beide Erkrankungen sind mit erheblichen Komplikationen verbunden und erfordern eine enge Zusammenarbeit zwischen Patient und medizinischem Fachpersonal. Von besonderer Bedeutung ist die psychologische und diätetische Unterstützung, da diese Erkrankungen überwiegend bei jungen Menschen in Kombination auftreten, die dadurch mit den Herausforderungen des Umgangs mit einer komplexen Diät und Insulinkontrolle konfrontiert sind und gleichzeitig versuchen, sozial anpassungsfähig zu sein.
Literatur
1 AGA Institute Medical Position Statement on the Diagnosis and Management of Celiac Disease. Gastroenterology 2006;131(6):1977-80.
2 West J, Logan RF, Hill PG, et al. Seroprevalence, correlates, and characteristics of undetected coeliac disease in England. Gut 2003;52(7):960-5.
3 Zarkadas M, Cranney A, Case S, et al. The impact of a gluten-free diet on adults with coeliac disease: results of a national survey. J Hum Nutr Diet 2006;19(1):41-9.
4 Mustalahti K, Lohiniemi S, Collin P, Vuolteenaho N, Laippala P, Mäki M. Gluten-free diet and quality of life in patients with screen-detected celiac disease. Eff Clin Pract 2002;5(3): 105-13.
5 The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993;329(14):977-86.
6 Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352(4):341-50.
7 Ventura A, Magazzù G, Greco L. Duration of exposure to gluten and risk for autoimmune disorders in patients with celiac disease. SIGEP Study Group for Autoimmune Disorders in Celiac Disease. Gastroenterology 1999; 117(2):297-303.
8 Goh C, Banerjee K. Prevalence of coeliac disease in children and adolescents with type 1 diabetes mellitus in a clinic based population. Postgrad Med J 2007;83(976):132-6.
9 Leeds JS, Hopper AD, Hadjivassiliou M, Tesfaye S, Sanders DS. High prevalence of microvascular complications in adults with type 1 diabetes and newly diagnosed celiac disease. Diabetes Care 2011;34(10):2158-63.
10 Coeliac Disease: Recognition and Assessment of Coeliac Disease. London: National Institute for Health and Clinical Excellence, 2009. Verfügbar auf: http://www.nice.org.uk/CG86
11 Diabetes UK. Verfügbar auf: http://www.diabetes.org.uk
12 Cerutti F, Bruno G, Chiarelli F, et al. Younger age at onset and sex predict celiac disease in children and adolescents with type 1 diabetes: an Italian multicenter study. Diabetes Care 2004;27(6):1294-8.
13 Camarca ME, Mozzillo E, Nugnes R, et al. Celiac disease in type 1 diabetes mellitus. Ital J Pediatr 2012;38:10.
14 Marchese A, Lovati E, Biagi F, Corazza GR. Coeliac disease and type 1 diabetes mellitus: epidemiology, clinical implications and effects of gluten-free diet. Endocrine 2012.
15 Mahmud FH, Murray JA, Kudva YC, et al. Celiac disease in type 1 diabetes mellitus in a North American community: prevalence, serologic screening, and clinical features. Mayo Clin Proc 2005;80(11):1429-34.
16 Shanahan F, McKenna R, McCarthy CF, Drury MI. Coeliac disease and diabetes mellitus: a study of 24 patients with HLA typing. Q J Med 1982;51(203):329-35.
17 Page SR, Lloyd CA, Hill PG, Peacock I, Holmes GK. The prevalence of coeliac disease in adult diabetes mellitus. QJM 1994;87(10):631-7.
18 Lorini R, Scaramuzza A, Vitali L, et al. Clinical aspects of coeliac disease in children with insulin-dependent diabetes mellitus. J Pediatr Endocrinol Metab 1996;9 Suppl 1:101-11.
19 Kaukinen K, Salmi J, Lahtela J, et al. No effect of gluten-free diet on the metabolic control of type 1 diabetes in patients with diabetes and celiac disease. Retrospective and controlled prospective survey. Diabetes Care 1999;22(10):1747-8.
20 Mollazadegan K, Kugelberg M, Montgomery SM, Sanders DS, Ludvigsson J, Ludvigsson JF. A population-based study of the risk of diabetic retinopathy in patients with type 1 diabetes and celiac disease. Diabetes Care September 10, 2012
21 West J, Logan RF, Card TR, Smith C, Hubbard R. Risk of vascular disease in adults with diagnosed coeliac disease: a population-based study. Aliment Pharmacol Ther 2004;20(1):73-9.
22 Lewis NR, Sanders DS, Logan RF, Fleming KM, Hubbard RB, West J. Cholesterol profi le in people with newly diagnosed coeliac disease: a comparison with the general population and changes following treatment. Br J Nutr 2009;102(4):509-13.
23 Valerio G, del Puente A, Buono P, et al. Quantitative ultrasound of proximal phalanxes in patients with type 1 diabetes mellitus. Diabetes Res Clin Pract 2004;64(3):161-6.
24 Valerio G, Spadaro R, Iafusco D, et al. The infl uence of gluten free diet on quantitative ultrasound of proximal phalanxes in children and adolescents with type 1 diabetes mellitus and celiac disease. Bone 2008;43(2):322-6.
Zöliakie, eine chronisch entzündliche Erkrankung des Dünndarms, kann als Zustand einer verstärkten immunologischen Reaktion auf mit der Nahrung aufgenommenes Gluten (aus Weizen, Gerste oder Roggen) bei genetisch entsprechend veranlagten Menschen definiert werden. [1] Die Prävalenz dieser Erkrankung wird mittlerweile weithin auf rund ein Prozent geschätzt. [2] Wesentlich für die Behandlung von Zöliakie ist die lebenslange Einhaltung einer strikten glutenfreien Diät (GFD), die in der Mehrheit der Fälle zu besseren klinischen Ergebnissen, psychologischem Wohlbefinden und mehr Lebensqualität führt. [3, 4] Glykämische Kontrolle bei T1DM Autoimmunerkrankungen, wie Funktionsstörungen der Schilddrüse, Sjögren-Syndrom, Addison-Krankheit und Typ-1-Diabetes mellitus (T1DM), treten bei Patienten mit Zöliakie häufiger auf als in der allgemeinen Bevölkerung. T1DM ist eine Störung des Glukosestoffwechsels, die aus Insulinmangel als Folge einer Zerstörung der insulinproduzierenden Betazellen der Bauchspeicheldrüse durch das körpereigene Immunsystem resultiert. Langfristige mikrovaskuläre und neurologische Komplikationen sind für eine höhere Morbidität und Mortalität bei T1DM verantwortlich. [5] Es hat sich gezeigt, dass eine intensive Blutzuckerkontrolle diese Komplikationen mindern und die Lebensqualität verbessern kann. [5, 6]
Allerdings erfordert eine solche glykämische Kontrolle eine komplexe lebenslange Diät- und Insulintherapie, obwohl diese potenzielle Beeinträchtigung bis zu einem gewissen Grad mithilfe des britischen Programms DAFNE (Dose Adjustment For Normal Eating) überwindbar ist. Es handelt sich hierbei um ein kontinuierliches Schulungsprogramm, das vorrangig von Diabetes- und Ernährungsberatern angeboten wird. DAFNE ermöglicht motivierten Patienten einen lockereren Umgang mit Diäteinschränkungen in Verbindung mit einer dynamischeren Insulintherapie.
Diabetes- vor Zöliakiediagnose
Der Zusammenhang zwischen Zöliakie und T1DM wurde vor mehr als 30 Jahren vor allem von Kinderärzten erkannt. Die Verbindung zwischen den zwei Erkrankungen wurde der Überlappung in den Prädispositionsgenen HLA-DQ2/DQ8 zugeschrieben, die Menschen für beide Störungen empfänglich macht. Es scheint klar zu sein, dass in der Mehrheit der Fälle T1DM ausnahmslos zuerst diagnostiziert wird. Dies kann daran liegen, dass T1DM im Allgemeinen akut einsetzt und die Symptome leichter zu erkennen sind. Darüber hinaus gibt es Hinweise dafür, dass zöliakiebetroffene Personen, die eine GFD einhalten, eine geringere Inzidenz anderer Autoimmunerkrankungen haben als Menschen, die eine solche Diät nicht befolgen. [7] Wenn diese Beobachtung stimmt, erklärt das auch, warum es so wenige Daten über die Entwicklung von T1DM nach einer Zöliakiediagnose gibt.
Prävalenz von Zöliakie und T1DM
Die Prävalenz von Zöliakie bei Kindern und Erwachsenen mit T1DM variiert je nach geografischer Lage, wobei Daten aus Großbritannien von 4,4 % [8] bzw. 3,3 % [9] ausgehen. Aktuelle NICE-Richtlinien (NICE = National Institute for Health and Clinical Excellence) empfehlen, dass T1DM-Patienten ein Zöliakietest vorgeschlagen werden soll – zum Zeitpunkt der Diagnose und später noch einmal, falls entsprechende Symptome auftreten. [10, 11] Zöliakie ist bei Frauen mit T1DM häufiger als bei Männern. Altersmäßig gesehen, tritt T1DM bei Patienten, die unter beiden Erkrankungen leiden, früher auf als bei jenen, die nur von T1DM betroff en sind. 12 Die gastrointestinalen Ausprägungen von Zöliakie sind bei T1DM nur selten festzustellen (in weniger als 10 % der Fälle), wobei die meisten Patienten entweder symptomfrei sind oder nur geringfügige Symptome haben. Patienten können zudem extraintestinale Symptome aufweisen, etwa Kleinwüchsigkeit, geringer BMI, verzögerte Pubertät oder Ernährungsmängel wie Eisenmangelanämie. [13, 14] Solche Komplikationen treten bei Kindern eher auf als bei Jugendlichen und Erwachsenen. 15 Einmal diagnostiziert, kann die Behandlung mit einer GFD helfen, diese Probleme zu lösen bzw. zu verhindern und zusätzlich zu einer Verringerung von Langzeitkomplikationen wie Osteoporose und bösartigen Tumoren beitragen.
Einhaltung der glutenfreien Diät
Dennoch kann eine GFD bei Patienten, die von beiden Erkrankungen betroffen sind, eine komplexe Angelegenheit sein. Die Einhaltung einer GFD funktioniert bei Patienten mit Zöliakiesymptomen am besten, während symptomfreie Patienten und Heranwachsende bzw. junge Erwachsene eine solche Diät mitunter sozial einschränkend finden, vor allem weil sie bereits mit einer komplexen chronischen Störung wie T1DM zu kämpfen haben. Unterstützung und feinfühlige Kommunikation seitens des medizinischen Fachpersonals und der Eltern gleichermaßen sind in solchen Fällen essenziell. [13]
Wirkung der GFD auf glykämische Kontrolle und Lebensqualität
Obwohl sich eine Vielzahl von Studien mit der Prävalenz von Zöliakie bei T1DM befasst, wurden andere wichtige klinische Faktoren bis dato nicht eingehend untersucht. Die wichtigsten Bereiche sind glykämische Kontrolle, Lebensqualität, mikrovaskuläre Komplikationen, kardiale Risikofaktoren und Knochendichte. Bisherige Untersuchungen zur Auswirkung von Zöliakie und einer GFD auf die glykämische Kontrolle brachten widersprüchliche Ergebnisse: Einige zeigten Verbesserungen [16], andere Verschlechterungen [17, 18], wieder andere überhaupt keine Auswirkungen [19]. Die Schwierigkeit bei der Auslegung dieser Studien ist, dass sich die meisten auf Kinder beziehen, klein, retrospektiv und unkontrolliert sind und diese wichtige Frage unbeantwortet lassen. Ebenso gab es bisher keine Bewertung der Lebensqualität vor und nach der Zöliakiediagnose bei erwachsenen Patienten mit T1DM, um die Auswirkungen der Diagnose und einer anschließenden GFD zu beurteilen. Der Versuch, sich zusätzlich zu den Einschränkungen einer Diabetesdiät an eine GFD zu halten, kann sich theoretisch negativ auf die Lebensqualität auswirken. Eine neuere Arbeit unserer Abteilung beschäftigt sich mit diesen Fragen. Wir konnten nachweisen, dass erwachsene T1DMPatienten mit neudiagnostizierter Zöliakie eine schlechtere glykämische Kontrolle (8,2 % versus 7,5 %, p = 0,05), ein niedrigeres Gesamtcholesterin (4,1 versus 4,9; p = 0,014), ein niedrigeres HDL-Cholesterin (1,1 versus 1,6; p = 0,017) sowie eine höhere Prävalenz von Retinopathie (58,3 % versus 25 %, p = 0,02), Nephropathie (45 % versus 5 %, p = 0,009) und peripherer Neuropathie (42,9 % versus 15 %; p = 0,11) haben. Nach einem Jahr GFD verbesserte sich insgesamt nur das Lipidprofil, wohingegen bei Personen, die sich streng an die Diät hielten, auch das HbA1c und die Nephropathie-Marker besser wurden. Darüber hinaus war die Behandlung mit einer GFD bei dieser Studie zuverlässig und es gab keinen Unterschied in Bezug auf die Lebensqualität (alle p > 0,1) nach einem Jahr GFD. Dies deutet darauf hin, dass sich eine GFD bei Patienten mit einer bereits komplexen Diabetesdiät nicht negativ auf die Lebensqualität auswirkt. 9 Allerdings war diese Studie klein dimensioniert (T1DM und Zöliakie: n = 12) und die Nachbetreuung endete nach einem Jahr.
Diabetische Retinopathie überwachen
Eine große schwedische bevölkerungsbasierte Kohortenstudie über das Risiko von diabetischer Retinopathie kam zu der Erkenntnis, dass die Dauer einer Zöliakie bei T1DM ein starker Indikator für die künftige Entwicklung einer diabetischen Retinopathie ist. 20 Im Vergleich zu Personen, die nur von T1DM betroffen sind, erhöht sich bei Menschen mit T1DM, die länger als zehn Jahre unter Zöliakie leiden, das Risiko, eine Retinopathie zu entwickeln, signifikant (um > 200 %, bereinigte Hazard-Ratio 3,01). Dies spricht für eine genauere Überwachung in Hinblick auf Retinopathie bei Patienten mit langjähriger Zöliakie und T1DM. [20]
Auswirkungen auf den Cholesterinspiegel
Neuere epidemiologische Studien legen überdies nahe, dass Zöliakiepatienten ein geringeres Risiko haben, ischämische Herzkrankheiten zu entwickeln, möglicherweise als Folge eines niedrigeren Cholesterinspiegels. [21] Eine andere Studie zeigte, dass bei neudiagnostizierter Zöliakie das Gesamtcholesterin zum Zeitpunkt der Diagnose und nach zwölf Monaten GFD geringer war und das HDLCholesterin trotz unveränderten Gesamtcholesterins um durchschnittlich 12 % anstieg. [22] Dies ist für Patienten mit erhöhtem kardialem Risiko und somit auch für T1DM-Patienten von besonderer Bedeutung.
T1DM und Knochenstoffwechsel
T1DM verursacht anerkanntermaßen einen veränderten Knochenstoff wechsel und eine veränderte Knochenstruktur, insbesondere in Zusammenhang mit der Dauer und einer schlechten Stoffwechseleinstellung des Diabetes. [23] Zöliakie selbst wird auch mit Osteopenie und Osteoporose in Zusammenhang gebracht. Der Knochenstoff wechsel bei Vorhandensein beider Störungen wurde kürzlich von einer italienischen Gruppe untersucht: Man fand heraus, dass die mittels Ultraschall gemessene phalangeale Knochenqualität bei Patienten mit T1DM und Zöliakie, die sich streng an eine GFD halten, ähnlich der von Patienten ist, die nur unter T1DM leiden (12,9 % vs. 8 %, p = 0,015). Eine höhere Prävalenz von Osteopenie ist bei Patienten mit beiden Erkrankungen gegeben, die berichteten, regelmäßig Diätsünden im Rahmen ihrer GFD zu begehen (45,5 %). [24] So lässt sich schlussfolgern, dass eine GFD und eine optimale glykämische Kontrolle eine wichtige Rolle bei der Prävention von Osteopenie als Folge des gleichzeitigen Auftretens dieser beiden chronischen Erkrankungen spielen. [24]
Fazit
Es ist wichtig, den Zusammenhang zwischen Zöliakie und T1DM zu erkennen. Beide Erkrankungen sind mit erheblichen Komplikationen verbunden und erfordern eine enge Zusammenarbeit zwischen Patient und medizinischem Fachpersonal. Von besonderer Bedeutung ist die psychologische und diätetische Unterstützung, da diese Erkrankungen überwiegend bei jungen Menschen in Kombination auftreten, die dadurch mit den Herausforderungen des Umgangs mit einer komplexen Diät und Insulinkontrolle konfrontiert sind und gleichzeitig versuchen, sozial anpassungsfähig zu sein.
Literatur
1 AGA Institute Medical Position Statement on the Diagnosis and Management of Celiac Disease. Gastroenterology 2006;131(6):1977-80.
2 West J, Logan RF, Hill PG, et al. Seroprevalence, correlates, and characteristics of undetected coeliac disease in England. Gut 2003;52(7):960-5.
3 Zarkadas M, Cranney A, Case S, et al. The impact of a gluten-free diet on adults with coeliac disease: results of a national survey. J Hum Nutr Diet 2006;19(1):41-9.
4 Mustalahti K, Lohiniemi S, Collin P, Vuolteenaho N, Laippala P, Mäki M. Gluten-free diet and quality of life in patients with screen-detected celiac disease. Eff Clin Pract 2002;5(3): 105-13.
5 The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993;329(14):977-86.
6 Tesfaye S, Chaturvedi N, Eaton SE, et al. Vascular risk factors and diabetic neuropathy. N Engl J Med 2005;352(4):341-50.
7 Ventura A, Magazzù G, Greco L. Duration of exposure to gluten and risk for autoimmune disorders in patients with celiac disease. SIGEP Study Group for Autoimmune Disorders in Celiac Disease. Gastroenterology 1999; 117(2):297-303.
8 Goh C, Banerjee K. Prevalence of coeliac disease in children and adolescents with type 1 diabetes mellitus in a clinic based population. Postgrad Med J 2007;83(976):132-6.
9 Leeds JS, Hopper AD, Hadjivassiliou M, Tesfaye S, Sanders DS. High prevalence of microvascular complications in adults with type 1 diabetes and newly diagnosed celiac disease. Diabetes Care 2011;34(10):2158-63.
10 Coeliac Disease: Recognition and Assessment of Coeliac Disease. London: National Institute for Health and Clinical Excellence, 2009. Verfügbar auf: http://www.nice.org.uk/CG86
11 Diabetes UK. Verfügbar auf: http://www.diabetes.org.uk
12 Cerutti F, Bruno G, Chiarelli F, et al. Younger age at onset and sex predict celiac disease in children and adolescents with type 1 diabetes: an Italian multicenter study. Diabetes Care 2004;27(6):1294-8.
13 Camarca ME, Mozzillo E, Nugnes R, et al. Celiac disease in type 1 diabetes mellitus. Ital J Pediatr 2012;38:10.
14 Marchese A, Lovati E, Biagi F, Corazza GR. Coeliac disease and type 1 diabetes mellitus: epidemiology, clinical implications and effects of gluten-free diet. Endocrine 2012.
15 Mahmud FH, Murray JA, Kudva YC, et al. Celiac disease in type 1 diabetes mellitus in a North American community: prevalence, serologic screening, and clinical features. Mayo Clin Proc 2005;80(11):1429-34.
16 Shanahan F, McKenna R, McCarthy CF, Drury MI. Coeliac disease and diabetes mellitus: a study of 24 patients with HLA typing. Q J Med 1982;51(203):329-35.
17 Page SR, Lloyd CA, Hill PG, Peacock I, Holmes GK. The prevalence of coeliac disease in adult diabetes mellitus. QJM 1994;87(10):631-7.
18 Lorini R, Scaramuzza A, Vitali L, et al. Clinical aspects of coeliac disease in children with insulin-dependent diabetes mellitus. J Pediatr Endocrinol Metab 1996;9 Suppl 1:101-11.
19 Kaukinen K, Salmi J, Lahtela J, et al. No effect of gluten-free diet on the metabolic control of type 1 diabetes in patients with diabetes and celiac disease. Retrospective and controlled prospective survey. Diabetes Care 1999;22(10):1747-8.
20 Mollazadegan K, Kugelberg M, Montgomery SM, Sanders DS, Ludvigsson J, Ludvigsson JF. A population-based study of the risk of diabetic retinopathy in patients with type 1 diabetes and celiac disease. Diabetes Care September 10, 2012
21 West J, Logan RF, Card TR, Smith C, Hubbard R. Risk of vascular disease in adults with diagnosed coeliac disease: a population-based study. Aliment Pharmacol Ther 2004;20(1):73-9.
22 Lewis NR, Sanders DS, Logan RF, Fleming KM, Hubbard RB, West J. Cholesterol profi le in people with newly diagnosed coeliac disease: a comparison with the general population and changes following treatment. Br J Nutr 2009;102(4):509-13.
23 Valerio G, del Puente A, Buono P, et al. Quantitative ultrasound of proximal phalanxes in patients with type 1 diabetes mellitus. Diabetes Res Clin Pract 2004;64(3):161-6.
24 Valerio G, Spadaro R, Iafusco D, et al. The infl uence of gluten free diet on quantitative ultrasound of proximal phalanxes in children and adolescents with type 1 diabetes mellitus and celiac disease. Bone 2008;43(2):322-6.

Zöliakie und Typ-1-Diabetes mellitus
Zöliakie und Typ-1-Diabetes mellitus sind häufige Krankheitsbilder, di...

Gluten and Gut-Brain Axis: Lesson Learned From Autism And Schizophrenia (2015)
Alessio Fasano, M.D.
Mucosal Immunology and Biology Research Center
Center for Celiac Research
Massachusetts General Hospital for Children
16th International Coeliac Disease Symposium 2015 in Prag
Pre-Conference Workshop on Gluten Sensitivity "The Evolving Planet of Gluten Related Disorders"
Mucosal Immunology and Biology Research Center
Center for Celiac Research
Massachusetts General Hospital for Children
16th International Coeliac Disease Symposium 2015 in Prag
Pre-Conference Workshop on Gluten Sensitivity "The Evolving Planet of Gluten Related Disorders"

Gluten and Gut-Brain Axis: Lesson Learned From Autism And Schizophrenia (2015)
Alessio Fasano, M.D.
Mucosal Immunology and Biology Research Center
...
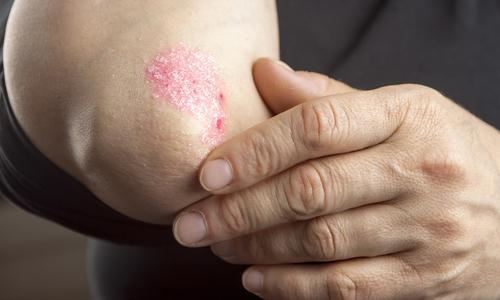
Association between Coeliac Disease and Psoriasis: Italian Primary Care Multicentre Study
Summary
Coeliac disease is increasingly associated with extraintestinal manifestations, among these, several skin disorders have been reported, with dermatitis herpetiformis being the best recognised. Several studies investigating the possible association between CD and psoriasis have been published, however results have so far proven to be inconclusive and most of the data on the effect of a gluten free diet on psoriatic skin lesions are contained within case reports.
In this prospective multicentre study, the patient records from 19 Italian primary care practices were screened for confirmed cases of psoriasis, following this 219 patients with a confirmed diagnosis of psoriasis were enrolled in to the study (111 males, 51%; mean age 54 years), and 264 age and sex matched controls without psoriasis. The severity of psoriasis amongst subjects was assessed at base-line and follow up, in addition to gastrointestinal symptoms. Serum levels of anti-tTG were recorded for all subjects and if positive, CD diagnosis was confirmed by histology on biopsy. A total of 49% of the 218 enrolled patients with psoriasis reported one or more GI symptom, the most common being heartburn/ acid regurgitation (27%) and bloating (16%). Nine out of 218 patients with psoriasis showed positive serology for CD compared to only 1 out of the 264 controls (P=<0.05). Histology confirmed the CD diagnosis in all subjects with positivity to anti-tTG antibodies. All patients with psoriasis and CD adhered to a gluten free diet and completed the 6 month follow up. At 3 months, all 9 patients showed significant improvement in the severity of their psoriasis, this improvement was maintained at 6 months in all but 1 patient whose symptoms worsened.
This study shows a significant epidemiological association between CD and psoriasis in the Italian population. However, the small number of psoriatic patients with evidence of CD cannot be considered as definitive evidence of a causal link between the two disorders. The authors of this study hypothesise that the presence of shared genes (at-risk HLA haplotypes) often used to explain the greater prevalence of CD in several autoimmune disorders, might be present in subjects affected by psoriasis. In addition, CD-related malabsorption may affect psoriasis by causing a vitamin D deficiency status. It is well known that low levels of vitamin D pre-dispose to psoriasis, and that expose to sunlight and topical vitamin D preparations improve psoriatic lesions. Furthermore, an abnormal intestinal permeability common in untreated CD may increase the passage of different immune triggers. The fact that the majority of psoriatic subjects with positive CD serology showed complete villous atrophy is concordant with the hypotheses of vitamin D malabsorption and altered intestinal permeability to the passage of immune triggers.
Resource: Dermatology 2015 Feb 3.
Coeliac disease is increasingly associated with extraintestinal manifestations, among these, several skin disorders have been reported, with dermatitis herpetiformis being the best recognised. Several studies investigating the possible association between CD and psoriasis have been published, however results have so far proven to be inconclusive and most of the data on the effect of a gluten free diet on psoriatic skin lesions are contained within case reports.
In this prospective multicentre study, the patient records from 19 Italian primary care practices were screened for confirmed cases of psoriasis, following this 219 patients with a confirmed diagnosis of psoriasis were enrolled in to the study (111 males, 51%; mean age 54 years), and 264 age and sex matched controls without psoriasis. The severity of psoriasis amongst subjects was assessed at base-line and follow up, in addition to gastrointestinal symptoms. Serum levels of anti-tTG were recorded for all subjects and if positive, CD diagnosis was confirmed by histology on biopsy. A total of 49% of the 218 enrolled patients with psoriasis reported one or more GI symptom, the most common being heartburn/ acid regurgitation (27%) and bloating (16%). Nine out of 218 patients with psoriasis showed positive serology for CD compared to only 1 out of the 264 controls (P=<0.05). Histology confirmed the CD diagnosis in all subjects with positivity to anti-tTG antibodies. All patients with psoriasis and CD adhered to a gluten free diet and completed the 6 month follow up. At 3 months, all 9 patients showed significant improvement in the severity of their psoriasis, this improvement was maintained at 6 months in all but 1 patient whose symptoms worsened.
This study shows a significant epidemiological association between CD and psoriasis in the Italian population. However, the small number of psoriatic patients with evidence of CD cannot be considered as definitive evidence of a causal link between the two disorders. The authors of this study hypothesise that the presence of shared genes (at-risk HLA haplotypes) often used to explain the greater prevalence of CD in several autoimmune disorders, might be present in subjects affected by psoriasis. In addition, CD-related malabsorption may affect psoriasis by causing a vitamin D deficiency status. It is well known that low levels of vitamin D pre-dispose to psoriasis, and that expose to sunlight and topical vitamin D preparations improve psoriatic lesions. Furthermore, an abnormal intestinal permeability common in untreated CD may increase the passage of different immune triggers. The fact that the majority of psoriatic subjects with positive CD serology showed complete villous atrophy is concordant with the hypotheses of vitamin D malabsorption and altered intestinal permeability to the passage of immune triggers.
Resource: Dermatology 2015 Feb 3.

Coeliac Disease in Women With Infertility - A Meta-Analysis
The first indications of a link between female infertility and coeliac disease was first described over 40 years ago. However, contemporary studies have failed to reach a consensus on whether patients with infertility should be screened for coeliac disease. Many studies on this subject are small, are of poor design and/ or lack a control arm. This latest meta-analysis on the subject sought to assess whether women with infertility are at higher risk of coeliac disease. Studies excluded from the meta-analysis included those without control data, those where diagnosis of coeliac disease was based only on serology, and studies where exact data regarding the number of patients included was unavailable. 105 studies were identified as a result of the initial literature search, of these only 16 were suitable for study in detail, 11 of which did not meet the inclusion criteria, leaving just 5 for inclusion in the meta-analysis to calculate the odds of having coeliac disease in women with all cause infertility and unexplained infertility. Four further studies that had been excluded on the basis that they lacked a control arm were included for calculation of the pooled prevalence of coeliac disease in women with infertility. Studies that reported coeliac disease diagnosis based on serology but with incomplete biopsy data were all included for the calculation of pooled serological prevalence of CD in women with infertility (12 studies). The meta-analysis showed that women with infertility had a 3.5 times increased odds of having coeliac disease in comparison with that in the control population. Of 422 women with unexplained infertility across the five included studies, 14 were found to have coeliac disease, representing a 6 fold increase in the odds of having coeliac disease in comparison to the control group. When data from studies without a control arm were analysed, pooled prevalence of coeliac disease amongst 884 women with all cause infertility and 623 women with unexplained infertility was 2.3% and 3.2%, respectively. Pooled serological prevalence of coeliac disease amongst women with all-cause infertility and unexplained infertility was 1.3% and 3.1%, respectively. Micronutrient deficiencies have been suggested as a possible mechanism for infertility amongst women with coeliac disease. In this meta-analysis, 28.5% of infertility patients with coeliac disease had iron deficiency in the 4 studies that reported iron status. Among the 4 studies that reported folic acid status, none of the patients with infertility and coeliac disease were deficient in this nutrient.
Although this study makes a case for screening women with infertility for coeliac disease. The authors acknowledge that their work alone cannot be used to prove a causal relationship between coeliac disease and infertility due to the limitation of the study design of case control studies, the small number of studies available overall and the small sample sizes used within these. A recent large population-based study of infertility and coeliac disease in UK women suggested that women with coeliac disease (both before and after diagnosis) do not have a greater chance of clinically recorded fertility problems than women without coeliac disease*. However, the design of this study has it's own limitations due to reliance on primary care records, the known mis-diagnosis of coeliac disease and delay in recording this within medical records.
Resource: Dhalwani N.N, West J et al (2014) Women with celiac disease present with fertility problems no more often than women in the general population. Gastroenterology 147: 1267-74
Although this study makes a case for screening women with infertility for coeliac disease. The authors acknowledge that their work alone cannot be used to prove a causal relationship between coeliac disease and infertility due to the limitation of the study design of case control studies, the small number of studies available overall and the small sample sizes used within these. A recent large population-based study of infertility and coeliac disease in UK women suggested that women with coeliac disease (both before and after diagnosis) do not have a greater chance of clinically recorded fertility problems than women without coeliac disease*. However, the design of this study has it's own limitations due to reliance on primary care records, the known mis-diagnosis of coeliac disease and delay in recording this within medical records.
Resource: Dhalwani N.N, West J et al (2014) Women with celiac disease present with fertility problems no more often than women in the general population. Gastroenterology 147: 1267-74

Causes of death in people with coeliac disease in England compared with the general population: a competing risk analysis
Abstract
Introduction:
Quantifying excess cause-specific mortality among people with coeliac disease (CD) compared with the general population accounting for competing risks will allow accurate information to be given on risk of death from specific causes.
Method:
We identified from the Clinical Practice Research Datalink all patients with CD linked to Office for National Statistics between 1998 and 2012. We selected controls by frequency matching from the registered general practice population within 10-year age bands. We calculated the adjusted cumulative incidence (including adjustment for competing risks) and excess cumulative incidence for different causes of death up to 10 years from diagnosis.
Results:
Of the 10 825 patients with CD, 773 died within the study period. The overall mortality rate among patients with CD was 128/10 000 person years compared with 153/10 000 in controls (HR=0.94 95% CI 0.84 to 1.01). We found no overall difference in the cumulative incidence of respiratory disease, digestive disease or cancer related death among cases and controls. The adjusted cumulative incidence of death from cardiovascular deaths was slightly lower compared with those without CD diagnosis (CD 0.32% vs controls 0.41%) with a corresponding excess cumulative incidence of −0.08% (95% CI −0.13 to −0.04). However, patients with CD had 0.15% excess risk (95% CI 0.03 to 0.27) of deaths from non-Hodgkin's lymphoma from the general population baseline risk.
Conclusions:
Overall, people with CD have no major excess risk of cancer, digestive disease or respiratory disease related or cardiovascular mortality compared with the general population. These findings should be reassuring to patients with CD and clinicians managing their care.
Resource: Abdul Sultan A, et al. Gut 2014;0:1–7
Alyshah Abdul Sultan, Colin J Crooks, Tim Card, Laila J Tata, Kate M Fleming, Joe West
Introduction:
Quantifying excess cause-specific mortality among people with coeliac disease (CD) compared with the general population accounting for competing risks will allow accurate information to be given on risk of death from specific causes.
Method:
We identified from the Clinical Practice Research Datalink all patients with CD linked to Office for National Statistics between 1998 and 2012. We selected controls by frequency matching from the registered general practice population within 10-year age bands. We calculated the adjusted cumulative incidence (including adjustment for competing risks) and excess cumulative incidence for different causes of death up to 10 years from diagnosis.
Results:
Of the 10 825 patients with CD, 773 died within the study period. The overall mortality rate among patients with CD was 128/10 000 person years compared with 153/10 000 in controls (HR=0.94 95% CI 0.84 to 1.01). We found no overall difference in the cumulative incidence of respiratory disease, digestive disease or cancer related death among cases and controls. The adjusted cumulative incidence of death from cardiovascular deaths was slightly lower compared with those without CD diagnosis (CD 0.32% vs controls 0.41%) with a corresponding excess cumulative incidence of −0.08% (95% CI −0.13 to −0.04). However, patients with CD had 0.15% excess risk (95% CI 0.03 to 0.27) of deaths from non-Hodgkin's lymphoma from the general population baseline risk.
Conclusions:
Overall, people with CD have no major excess risk of cancer, digestive disease or respiratory disease related or cardiovascular mortality compared with the general population. These findings should be reassuring to patients with CD and clinicians managing their care.
Resource: Abdul Sultan A, et al. Gut 2014;0:1–7
Alyshah Abdul Sultan, Colin J Crooks, Tim Card, Laila J Tata, Kate M Fleming, Joe West

Systematic review with meta-analysis: associations between coeliac disease and type 1 diabetes
Abstract
BACKGROUND:
In the past decade, a number of population-based studies have examined the prevalence of coeliac disease in individuals with type 1 diabetes but prevalences have differed considerably.
AIM:
To examine the prevalence of coeliac disease in individuals with type 1 diabetes.
METHODS:
A systematic review of English-language articles published in PubMed Medline between 2000 and May 2014. Search terms included 'celiac disease' or 'coeliac disease' and 'diabetes mellitus'. Studies were selected with at least 100 individuals with type 1 diabetes being screened for coeliac disease where the coeliac diagnosis was later confirmed through small intestinal biopsy. Data synthesis used random-effects inverse variance-weighted models, and metaregression was used to examine heterogeneity in subgroups.
RESULTS:
A pooled analysis, based on 26,605 patients with type 1 diabetes, found a prevalence of biopsy-confirmed coeliac disease of 6.0% (95% CI = 5.0-6.9%). Heterogeneity was large (I(2) = 93.2%). The prevalence was lower in adults with type 1 diabetes (2.7%), and in mixed populations with both children and adults with type 1 diabetes (4.7%) than in children (6.2%) with type 1 diabetes (P < 0.001). Additional subgroup analyses could not explain the large variation in coeliac disease prevalence between studies.
CONCLUSION:
More than one in twenty patients with type 1 diabetes have biopsy-verified coeliac disease. This prevalence is high enough to motivate screening for coeliac disease among patients with type 1 diabetes.
Resource: Aliment Pharmacol Ther. 2014 Nov;40(10):1123-32. doi: 10.1111/apt.12973. Epub 2014 Oct 1.
BACKGROUND:
In the past decade, a number of population-based studies have examined the prevalence of coeliac disease in individuals with type 1 diabetes but prevalences have differed considerably.
AIM:
To examine the prevalence of coeliac disease in individuals with type 1 diabetes.
METHODS:
A systematic review of English-language articles published in PubMed Medline between 2000 and May 2014. Search terms included 'celiac disease' or 'coeliac disease' and 'diabetes mellitus'. Studies were selected with at least 100 individuals with type 1 diabetes being screened for coeliac disease where the coeliac diagnosis was later confirmed through small intestinal biopsy. Data synthesis used random-effects inverse variance-weighted models, and metaregression was used to examine heterogeneity in subgroups.
RESULTS:
A pooled analysis, based on 26,605 patients with type 1 diabetes, found a prevalence of biopsy-confirmed coeliac disease of 6.0% (95% CI = 5.0-6.9%). Heterogeneity was large (I(2) = 93.2%). The prevalence was lower in adults with type 1 diabetes (2.7%), and in mixed populations with both children and adults with type 1 diabetes (4.7%) than in children (6.2%) with type 1 diabetes (P < 0.001). Additional subgroup analyses could not explain the large variation in coeliac disease prevalence between studies.
CONCLUSION:
More than one in twenty patients with type 1 diabetes have biopsy-verified coeliac disease. This prevalence is high enough to motivate screening for coeliac disease among patients with type 1 diabetes.
Resource: Aliment Pharmacol Ther. 2014 Nov;40(10):1123-32. doi: 10.1111/apt.12973. Epub 2014 Oct 1.

Cognitive impairment in coeliac disease improves on a gluten-free diet and correlates with histological and serological indices of disease severity
SUMMARY
Background
Mild impairments of cognition or ‘Brain fog’ are often reported by patients with coeliac disease but the nature of these impairments has not been systematically investigated.
Aim
This longitudinal pilot study investigated relationships between cognitive function and mucosal healing in people with newly diagnosed coeliac disease commencing a gluten-free diet.
Methods
Eleven patients (8 females, 3 males), mean age 30 (range 22–39) years, were tested with a battery of cognitive tests at weeks 0, 12 and 52. Information processing efficacy, memory, visuospatial ability, motoric function and attention were tested. Small bowel biopsies were collected via routine gastroscopy at weeks 12 and 52 and were compared to baseline Marsh scores. Cognitive performance was compared to serum concentrations of tissue transglutaminase antibodies, biopsy outcomes and other biological markers.
Results
All patients had excellent adherence to the diet. Marsh scores improved significantly (P = 0.001, Friedman's test) and tissue transglutaminase antibody concentrations decreased from a mean of 58.4 at baseline to 16.8 U/mL at week 52 (P = 0.025). Four of the cognitive tests assessing verbal fluency, attention and motoric function showed significant improvement over the 12 months and strongly correlated with the Marsh scores and tissue transglutaminase antibody levels (r = 0.377–0.735; all P < 0.05). However, no meaningful patterns of correlations were found for nutritional or biochemical markers, or markers of intestinal permeability.
Conclusions
In newly diagnosed coeliac disease, cognitive performance improves with adherence to the gluten-free diet in parallel to mucosal healing. Suboptimal levels of cognition in untreated coeliac disease may affect the performance of everyday tasks.
Resource: Alimentary Pharmacology & Therapeutics Volume 40, Issue 2, pages 160–170, July 2014
Background
Mild impairments of cognition or ‘Brain fog’ are often reported by patients with coeliac disease but the nature of these impairments has not been systematically investigated.
Aim
This longitudinal pilot study investigated relationships between cognitive function and mucosal healing in people with newly diagnosed coeliac disease commencing a gluten-free diet.
Methods
Eleven patients (8 females, 3 males), mean age 30 (range 22–39) years, were tested with a battery of cognitive tests at weeks 0, 12 and 52. Information processing efficacy, memory, visuospatial ability, motoric function and attention were tested. Small bowel biopsies were collected via routine gastroscopy at weeks 12 and 52 and were compared to baseline Marsh scores. Cognitive performance was compared to serum concentrations of tissue transglutaminase antibodies, biopsy outcomes and other biological markers.
Results
All patients had excellent adherence to the diet. Marsh scores improved significantly (P = 0.001, Friedman's test) and tissue transglutaminase antibody concentrations decreased from a mean of 58.4 at baseline to 16.8 U/mL at week 52 (P = 0.025). Four of the cognitive tests assessing verbal fluency, attention and motoric function showed significant improvement over the 12 months and strongly correlated with the Marsh scores and tissue transglutaminase antibody levels (r = 0.377–0.735; all P < 0.05). However, no meaningful patterns of correlations were found for nutritional or biochemical markers, or markers of intestinal permeability.
Conclusions
In newly diagnosed coeliac disease, cognitive performance improves with adherence to the gluten-free diet in parallel to mucosal healing. Suboptimal levels of cognition in untreated coeliac disease may affect the performance of everyday tasks.
Resource: Alimentary Pharmacology & Therapeutics Volume 40, Issue 2, pages 160–170, July 2014

Managing coeliac disease in patients with diabetes
Abstract
The association between coeliac disease and type 1 diabetes has long been established. The combination of genetic susceptibility along with a potential role for gluten in the pathogenesis of autoimmunity makes defining gluten's role in type 1 diabetes extremely important. Evidence supporting the role of a gluten-free diet to improve complications associated with type 1 diabetes is not robust. However there is evidence to support improved growth, bone density and potentially the prevention of additional autoimmune diseases in patients with coeliac disease and type 1 diabetes. The gluten free diet is expensive and challenging to adhere to in people already on a modified diet. Early identification of those who have coeliac disease and would benefit from a gluten-free diet is of utmost importance to prevent complications associated with type 1 diabetes and coeliac disease.
Resource: Diabetes Obes Metab. 2014 May 9
The association between coeliac disease and type 1 diabetes has long been established. The combination of genetic susceptibility along with a potential role for gluten in the pathogenesis of autoimmunity makes defining gluten's role in type 1 diabetes extremely important. Evidence supporting the role of a gluten-free diet to improve complications associated with type 1 diabetes is not robust. However there is evidence to support improved growth, bone density and potentially the prevention of additional autoimmune diseases in patients with coeliac disease and type 1 diabetes. The gluten free diet is expensive and challenging to adhere to in people already on a modified diet. Early identification of those who have coeliac disease and would benefit from a gluten-free diet is of utmost importance to prevent complications associated with type 1 diabetes and coeliac disease.
Resource: Diabetes Obes Metab. 2014 May 9

Persistent mucosal damage and risk of fracture in celiac disease.
ABSTRACT
CONTEXT:
Celiac disease (CD) is associated with an increased fracture risk, an increase that persists after diagnosis. A significant proportion of patients with CD have persistent villous atrophy (VA) on follow-up biopsy.
OBJECTIVE:
The objective of the study was to determine whether persistent VA impacts long-term fracture risk.
DESIGN:
This was a cohort study.
SETTING AND PATIENTS:
We identified all patients in Sweden with histological evidence of CD who underwent a follow-up biopsy and compared patients with persistent VA with those with mucosal healing.
MAIN OUTCOME MEASURES:
The following were measured: 1) any fracture; 2) likely osteoporotic fracture (defined as fractures of the hip, distal forearm, thoracic and lumbar spine, or proximal humerus); and 3) hip fracture.
RESULTS:
Of 7146 patients, VA was present on follow-up biopsy in 43%. There was no significant association between persistent VA and overall fractures [hazard ratio (HR) of persistent VA compared with those with healing 0.93, 95% confidence interval (CI) 0.82-1.06] or with likely osteoporotic fractures (HR 1.11, 95% CI 0.84-1.46). Persistent VA was associated with an increased risk of hip fracture (HR 1.67, 95% CI 1.05-2.66). Hip fracture risk increased, depending on the degree of VA (HR for partial VA compared with those with healing 1.70, 95% CI 0.82-3.49, HR for subtotal/total VA compared with those with healing 2.16, 95% CI 1.06-4.41).
CONCLUSIONS:
Persistent VA on follow-up biopsy is predictive of hip fracture risk. The association between persistent VA and hip fractures, but not fractures overall, implies that thinner sc tissue and fall or trauma may be mechanisms by which persistent VA confers an increased fracture risk.
Resource: J Clin Endocrinol Metab. 2014 Feb
CONTEXT:
Celiac disease (CD) is associated with an increased fracture risk, an increase that persists after diagnosis. A significant proportion of patients with CD have persistent villous atrophy (VA) on follow-up biopsy.
OBJECTIVE:
The objective of the study was to determine whether persistent VA impacts long-term fracture risk.
DESIGN:
This was a cohort study.
SETTING AND PATIENTS:
We identified all patients in Sweden with histological evidence of CD who underwent a follow-up biopsy and compared patients with persistent VA with those with mucosal healing.
MAIN OUTCOME MEASURES:
The following were measured: 1) any fracture; 2) likely osteoporotic fracture (defined as fractures of the hip, distal forearm, thoracic and lumbar spine, or proximal humerus); and 3) hip fracture.
RESULTS:
Of 7146 patients, VA was present on follow-up biopsy in 43%. There was no significant association between persistent VA and overall fractures [hazard ratio (HR) of persistent VA compared with those with healing 0.93, 95% confidence interval (CI) 0.82-1.06] or with likely osteoporotic fractures (HR 1.11, 95% CI 0.84-1.46). Persistent VA was associated with an increased risk of hip fracture (HR 1.67, 95% CI 1.05-2.66). Hip fracture risk increased, depending on the degree of VA (HR for partial VA compared with those with healing 1.70, 95% CI 0.82-3.49, HR for subtotal/total VA compared with those with healing 2.16, 95% CI 1.06-4.41).
CONCLUSIONS:
Persistent VA on follow-up biopsy is predictive of hip fracture risk. The association between persistent VA and hip fractures, but not fractures overall, implies that thinner sc tissue and fall or trauma may be mechanisms by which persistent VA confers an increased fracture risk.
Resource: J Clin Endocrinol Metab. 2014 Feb

Association between Coeliac Disease and Psoriasis: Italian Primary Care Multicentre Study
Summary
Coeliac disease is increasingly associated with extraintest...

Coeliac Disease in Women With Infertility - A Meta-Analysis
The first indications of a link between female infertility and coeliac...

Causes of death in people with coeliac disease in England compared with the general population: a competing risk analysis
Abstract
Introduction:
Quantifying excess cause-specific mortality...

Systematic review with meta-analysis: associations between coeliac disease and type 1 diabetes
Abstract
BACKGROUND:
In the past decade, a number of population-ba...

Cognitive impairment in coeliac disease improves on a gluten-free diet and correlates with histological and serological indices of disease severity
SUMMARY
Background
Mild impairments of cognition or ‘Brain fog’ ar...

Managing coeliac disease in patients with diabetes
Abstract
The association between coeliac disease and type 1 diabete...

Persistent mucosal damage and risk of fracture in celiac disease.
ABSTRACT
CONTEXT:
Celiac disease (CD) is associated with an increa...
www.drschaer-institute.com
