La microbiota intestinal en la salud y la enfermedad

A medida que aparecen nuevas pruebas y mejores técnicas de análisis, obtenemos más información sobre nuestras bacterias intestinales. Cada vez es más evidente que el tipo y la cantidad relativa de bacterias en el intestino tienen un papel importante tanto en la salud, como en la enfermedad.
Las empresas biotecnológicas están invirtiendo más en tecnologías para estudiar el papel de este «microbioma» como posible moderador de la salud intestinal y del sistema inmunitario innato. El aumento de la incidencia de enfermedades inmunológicas y de trastornos neurológicos no puede explicarse por las variaciones de la genética humana, [1] y al centrarnos en nuestros «otros genomas» para hallar pistas, con frecuencia la disbiosis y la desaparición de diversidad se atribuyen a dichas enfermedades.
Lo que ha quedado sobradamente demostrado a partir del trabajo llevado a cabo en metagenómica, es que una mayor diversidad bacteriana o «riqueza genética» está fuertemente asociada a un mejor estado de salud.
Lo que ha quedado sobradamente demostrado a partir del trabajo llevado a cabo en metagenómica, es que una mayor diversidad bacteriana o «riqueza genética» está fuertemente asociada a un mejor estado de salud.
INFO Definiciones clave
- Microbioma: denominación que engloba los microorganismos intestinales.
- Disbiosis: situación en que uno o más organismos microbianos potencialmente perjudiciales son predominantes en la población microbiana intestinal. [3]
- Metagenómica: ámbito de estudio que compara genomas completos.
- Phila: término taxonómico utilizado para clasificar organismos en grupos con otras propiedades similares.
- Enterotipo: término utilizado para dividir a los humanos en grupos basándose en las bacterias intestinales que presentan.
- Transcriptoma: genes que se han expresado como proteínas, es decir, la parte activa del genoma.
¿Qué especie conforma el microbioma?
Aunque a nivel de especies existe una gran variación entre individuos – la mayoría de personas presentan unas 160 especies de 1000 posibles-, los phila representados en el microbioma son bastante limitados. Para el microbioma humano se han definido tres enterotipos principales. [2] Los géneros de marcadores a cuyo microbioma pertenece un sujeto son Bacteroides, Prevotella y Ruminococcus (este último se asocia más con la presencia de Methanobrevibacter). [1]
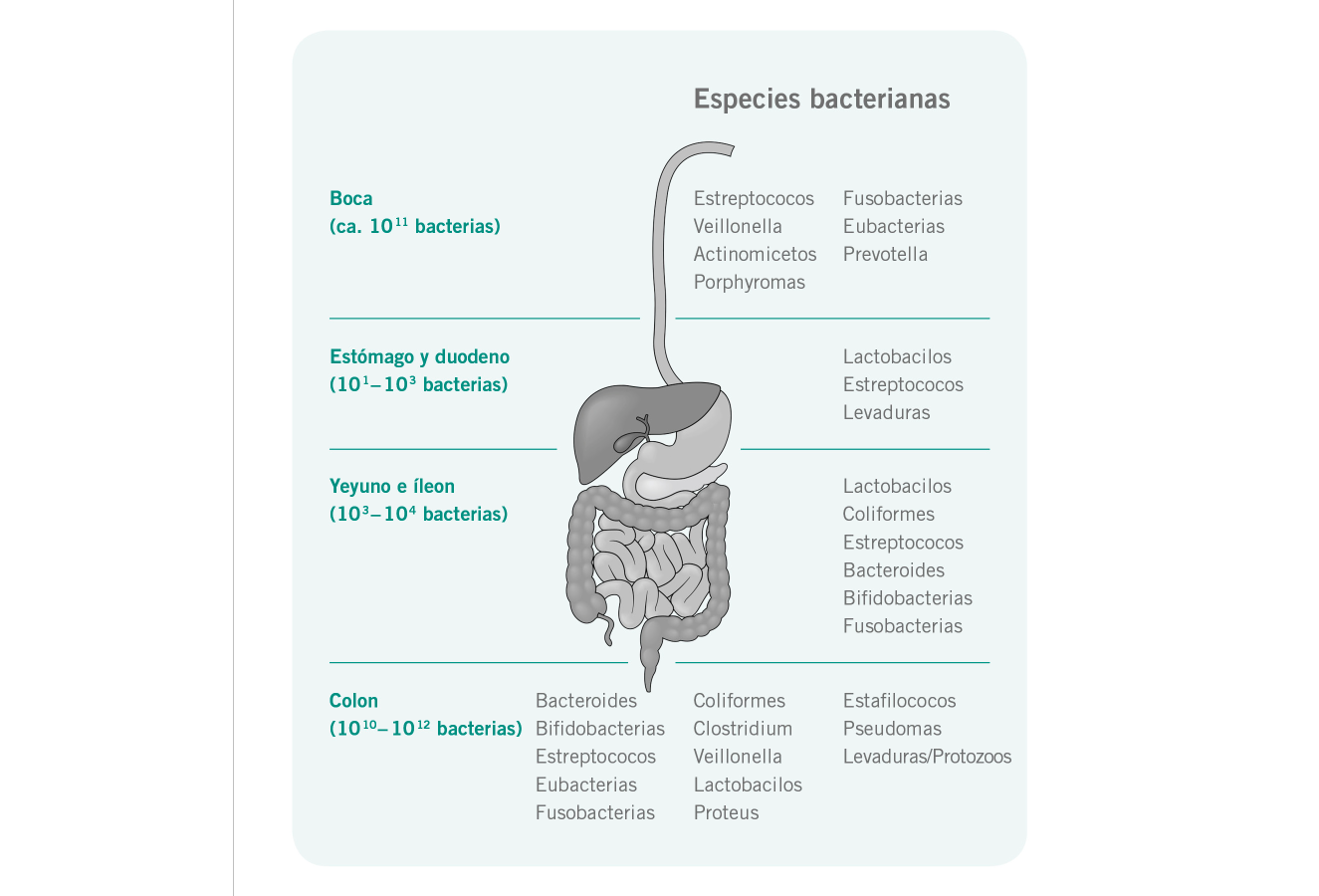
Función
La función de la microbiota intestinal aún no se conoce totalmente, aunque algunos aspectos clave son: modulación y señalización del sistema inmunitario, producción de mensajeros del sistema nervioso, producción de vitaminas esenciales, regulación del metabolismo de las grasas, producción de ácidos grasos de cadena corta (AGCC); concretamente el butirato y ácidos grasos de cadena ramificada. En función del sustrato fermentado, el microbioma también produce hidrógeno, dióxido de carbono y gas metano, amoniaco, aminas y compuestos fenólicos. [3] La simbiosis entre el humano y la microbiota intestinal es cada vez más evidente. Se ha acuñado el término «superorganismo» cuando el cuerpo humano ha empezado a considerarse un organismo conglomerado de nuestro transcriptoma y el transcriptoma plástico, mucho mayor, de la microbiota intestinal. Los genes codificados por las bacterias intestinales superan los nuestros en más de 100 veces, [4] por tanto, no sorprende que se preste mucha atención a este «otro genoma» para abordar las causas, la prevención y la cura de las enfermedades. A veces, en la bibliografía se hace referencia al sistema nervioso entérico (SNE) como «el segundo cerebro». Esto se debe a que está compuesto por más de 200 millones de neuronas. [5] El SNE envía señales del intestino al cerebro mediante señalización aferente endocrina, neuronal e inmunitaria. [5] Además, el tejido linfoide asociado al intestino (TLAI), que regularmente toma muestras y responde a señales emitidas desde el lumen intestinal, se considera el órgano defensivo más importante que tiene el cuerpo frente a las infecciones. [5]
La combinación de interacciones entre el SNE, el microbioma y el TLAI tiene el gran potencial de efectuar cambios en el bienestar físico, inmunológico y emocional.
La combinación de interacciones entre el SNE, el microbioma y el TLAI tiene el gran potencial de efectuar cambios en el bienestar físico, inmunológico y emocional.
¿Cómo se forma el microbioma?
El microbioma se desarrolla desde el nacimiento. La vía de parto y la alimentación temprana afectan al desarrollo inicial del microbioma, y el destete y el entorno (rural o urbano) durante la infancia, probablemente afectan al desarrollo del microbioma maduro. Estudios realizados en poblaciones aisladas de África revelan una colonización bacteriana única y divergente respecto a la de una cohorte occidental, lo que indica que el entorno es una fuerza impulsora en la colonización. [6] En estudios con gemelos también se ha demostrado que, al menos con algunas clasificaciones, hay una influencia genética evidente en la abundancia de la especie. [7] Los cónyuges de gemelos idénticos también mostraron correlaciones positivas, lo que se suma al concepto de que tanto lo innato como lo adquirido puede afectar a la riqueza genética de la microbiota intestinal. [8]
En las personas mayores el microbioma vuelve a cambiar, por motivos que aún se desconocen. En la población anciana se observa una reducción de las bacterias productoras de butirato y de la riqueza genética del microbioma. Las personas mayores que viven en comunidad mantienen una mayor riqueza genética, debido supuestamente a una dieta más variada en comparación con los mayores con cuidados de larga duración. [9]
En las personas mayores el microbioma vuelve a cambiar, por motivos que aún se desconocen. En la población anciana se observa una reducción de las bacterias productoras de butirato y de la riqueza genética del microbioma. Las personas mayores que viven en comunidad mantienen una mayor riqueza genética, debido supuestamente a una dieta más variada en comparación con los mayores con cuidados de larga duración. [9]
¿Cómo nos afectan los cambios?
La disbiosis se asocia con diferentes enfermedades, [3] de hecho, recientemente se ha publicado un estudio de las enfermedades concretas y las alteraciones asociadas en poblaciones bacterianas. [4] Las nuevas tecnologías han permitido desarrollar un tipo de impronta bacteriana para algunas enfermedades que podría constituir un potente instrumento de diagnóstico no invasivo y un posible objetivo de tratamiento para abordar estas enfermedades.
En estudios sobre obesidad, los sujetos con una riqueza genética reducida presentaron una mayor adiposidad global, resistencia a la insulina y dislipidemia y un fenotipo inflamatorio más pronunciado. [10] Además, con el tiempo, aumentaron de peso. Para más información, Goodrich et al. (2014) ofrecen información sobre la heredabilidad de un microbioma generador de obesidad y la posible influencia de los metanógenos y de la especie Christensenella en los trastornos metabólicos.
Estudios en niños con disposición genética a la enfermedad celiaca (EC) revelan una reducción de actinobacterias (lo que incluye bifidobacterias) y un aumento de las especies Firmicutes y Proteobacteria. [11] Sin embargo, aún no se ha demostrado la asociación entre las alteraciones microbianas y el desarrollo de enfermedad celiaca. [12]
Se ha identificado disbiosis en la secuenciación del microbioma en el síndrome del colon irritable (SCI), [13] y nuevos estudios han identificado varias diferencias en las bacterias intestinales en varios subtipos de SCI tanto en poblaciones del lumen como de las mucosas. [14-16] En un estudio piloto pediátrico reciente, se concluyó que el microbioma puede ser indicativo de la probabilidad de que la dieta baja en FODMAP sea eficaz para aliviar los síntomas. [17]
Qin et al. (2012), también identificaron un comportamiento antagónico entre las bacterias beneficiosas y perjudiciales en la diabetes de tipo 2. Una reducción de las bacterias productoras de butirato puede ser indicativa de un mayor riesgo de desarrollar comorbilidades relacionadas con la obesidad. [18]
En estudios sobre obesidad, los sujetos con una riqueza genética reducida presentaron una mayor adiposidad global, resistencia a la insulina y dislipidemia y un fenotipo inflamatorio más pronunciado. [10] Además, con el tiempo, aumentaron de peso. Para más información, Goodrich et al. (2014) ofrecen información sobre la heredabilidad de un microbioma generador de obesidad y la posible influencia de los metanógenos y de la especie Christensenella en los trastornos metabólicos.
Estudios en niños con disposición genética a la enfermedad celiaca (EC) revelan una reducción de actinobacterias (lo que incluye bifidobacterias) y un aumento de las especies Firmicutes y Proteobacteria. [11] Sin embargo, aún no se ha demostrado la asociación entre las alteraciones microbianas y el desarrollo de enfermedad celiaca. [12]
Se ha identificado disbiosis en la secuenciación del microbioma en el síndrome del colon irritable (SCI), [13] y nuevos estudios han identificado varias diferencias en las bacterias intestinales en varios subtipos de SCI tanto en poblaciones del lumen como de las mucosas. [14-16] En un estudio piloto pediátrico reciente, se concluyó que el microbioma puede ser indicativo de la probabilidad de que la dieta baja en FODMAP sea eficaz para aliviar los síntomas. [17]
Qin et al. (2012), también identificaron un comportamiento antagónico entre las bacterias beneficiosas y perjudiciales en la diabetes de tipo 2. Una reducción de las bacterias productoras de butirato puede ser indicativa de un mayor riesgo de desarrollar comorbilidades relacionadas con la obesidad. [18]
¿Cómo podemos mejorar el microbioma?
Estudios nutricionales han confirmado el poder de las acciones dietéticas en la alteración del microbioma [19] y este es un ámbito con un gran potencial. El modo evidente en que se puede manipular la microbiota es alimentando al huésped y a la microbiota. La dieta alta en grasas y en proteínas se ha asociado con el enterotipo Bacteroides, y una dieta rica en hidratos de carbono se asocia con el enterotipo Prevotella. [20] Los cambios de corta duración en las dietas (~10 días) demostraron que se modificaba la composición del microbioma, sin afectar de manera significativa a la identidad del enterotipo. Con suplementos dietéticos altos en fibra se han conseguido niveles elevados de Faecalibacterium prausnitzii, Bifidobacterium y el grupo XIVa de Clostridium; estos tres grupos se suelen asociar con un mejor estado de salud. [1,21]
En otros estudios se ha demostrado claramente que los prebióticos y los probióticos en diferentes grados son útiles para el desarrollo de bifidobacterias y lactobacilos beneficiosos. En varios estudios se han observado mecanismos mediante los cuales diferentes especies de lactobacilos y bifidobacterias no solamente producen efectos beneficiosos en el huésped, sino que inhiben la fijación y la actividad de enteropatógenos invasores. [4] Tal vez en el futuro se incorporen como diana más cepas bacterianas (como Akkermansia mucinophila y Christensenella minuta) con suplementos prebióticos y probióticos. [4]
El trasplante de microbiota fecal es otra técnica para corregir rápidamente un microbioma alterado. Hasta la fecha, los estudios en pacientes infectados por C. diff han obtenido resultados prometedores. Por ejmplo, el trasplante de microbiota fecal de donantes sanos reveló una mejora en la resistencia a la insulina en pacientes con síndrome metabólico [22] – lo cual respalda el concepto cada vez más extendido de que la disbiosis tiene una función importante en el desarrollo de los trastornos relacionados con la obesidad. Las estrategias antimicrobianas para modular el microbioma tal vez tengan un efecto terapéutico en el futuro, sin embargo, los conocimientos actuales de la eficacia en este ámbito se basan en modelos experimentales con ratones, y de momento no son estrategias recomendables. [4] Las recomendaciones actuales pasan por llevar una dieta variada y equilibrada que incluya todos los grupos de alimentos para proporcionar sustratos variados y reducir las probabilidades de que especies desfavorables se hagan dominantes en el intestino. Es probable que los prebióticos y los probióticos ayuden en caso de alteraciones en el microbioma generadas por antibióticos o por un episodio de gastroenteritis, donde se considera que son seguros para un uso general. Un análisis de heces capaz de detectar una reducción en la diversidad del microbioma, puede ser un instrumento útil para la predicción temprana de enfermedades y para tomar medidas preventivas.
En otros estudios se ha demostrado claramente que los prebióticos y los probióticos en diferentes grados son útiles para el desarrollo de bifidobacterias y lactobacilos beneficiosos. En varios estudios se han observado mecanismos mediante los cuales diferentes especies de lactobacilos y bifidobacterias no solamente producen efectos beneficiosos en el huésped, sino que inhiben la fijación y la actividad de enteropatógenos invasores. [4] Tal vez en el futuro se incorporen como diana más cepas bacterianas (como Akkermansia mucinophila y Christensenella minuta) con suplementos prebióticos y probióticos. [4]
El trasplante de microbiota fecal es otra técnica para corregir rápidamente un microbioma alterado. Hasta la fecha, los estudios en pacientes infectados por C. diff han obtenido resultados prometedores. Por ejmplo, el trasplante de microbiota fecal de donantes sanos reveló una mejora en la resistencia a la insulina en pacientes con síndrome metabólico [22] – lo cual respalda el concepto cada vez más extendido de que la disbiosis tiene una función importante en el desarrollo de los trastornos relacionados con la obesidad. Las estrategias antimicrobianas para modular el microbioma tal vez tengan un efecto terapéutico en el futuro, sin embargo, los conocimientos actuales de la eficacia en este ámbito se basan en modelos experimentales con ratones, y de momento no son estrategias recomendables. [4] Las recomendaciones actuales pasan por llevar una dieta variada y equilibrada que incluya todos los grupos de alimentos para proporcionar sustratos variados y reducir las probabilidades de que especies desfavorables se hagan dominantes en el intestino. Es probable que los prebióticos y los probióticos ayuden en caso de alteraciones en el microbioma generadas por antibióticos o por un episodio de gastroenteritis, donde se considera que son seguros para un uso general. Un análisis de heces capaz de detectar una reducción en la diversidad del microbioma, puede ser un instrumento útil para la predicción temprana de enfermedades y para tomar medidas preventivas.
Autor
BRIDGETTE WILSON (LICENCIATURA, MÁSTER, POSGRADO, DIETISTA CERTIFICADA)
Dietista investigadora del King’s College de Londres. Bridgette es estudiante de doctorado del King’s College de Londres y dietista certificada. Finalizó la licenciatura en Ciencias Biológicas y un máster en Biología Molecular antes de formarse como dietista. Después de trabajar en el sistema sanitario del Reino Unido, Bridgette volvió a la investigación para centrarse en el ámbito de la Gastroenterología. Actualmente, trabaja en el equipo del profesor Kevin Whelan y de la doctora Miranda Lomer en el King’s College de Londres y está llevando a cabo una investigación sobre las intervenciones dietéticas para el síndrome del colon irritable.
Dietista investigadora del King’s College de Londres. Bridgette es estudiante de doctorado del King’s College de Londres y dietista certificada. Finalizó la licenciatura en Ciencias Biológicas y un máster en Biología Molecular antes de formarse como dietista. Después de trabajar en el sistema sanitario del Reino Unido, Bridgette volvió a la investigación para centrarse en el ámbito de la Gastroenterología. Actualmente, trabaja en el equipo del profesor Kevin Whelan y de la doctora Miranda Lomer en el King’s College de Londres y está llevando a cabo una investigación sobre las intervenciones dietéticas para el síndrome del colon irritable.
Referencias
- Blottiere, H.M., et al., Human intestinal metagenomics: state of the art and future. Curr Opin Microbiol, 2013. 16(3): p. 232-9.
- Qin, J., et al., A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010. 464(7285): p. 59-65.
- Roberfroid, M., et al., Prebiotic effects: metabolic and health benefits. British Journal of Nutrition, 2010. 104(S2): p. S1-S63.
- Walsh, C.J., et al., Beneficial modulation of the gut microbiota. FEBS letters, 2014. 588(22): p. 4120-4130.
- Al Omran, Y. and Q. Aziz, The brain-gut axis in health and disease, in Microbial Endocrinology: The Microbiota-Gut-Brain Axis in Health and Disease. 2014, Springer. p. 135-153.
- De Filippo, C., et al., Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proceedings of the National Academy of Sciences, 2010. 107(33): p. 14691-14696.
- Goodrich, J.K., et al., Human genetics shape the gut microbiome. Cell, 2014. 159(4): p. 789-799.
- Nelson, K.E., et al., Metagenomics of the human body. 2011: Springer.
- Claesson, M.J., et al., Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proceedings of the National Academy of Sciences, 2011. 108(Supplement 1): p. 4586-4591.
- Le Chatelier, E., et al., Richness of human gut microbiome correlates with metabolic markers. Nature, 2013. 500(7464): p. 541-546.
- Olivares, M., et al., The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut, 2014: p. gutjnl-2014-306931.
- McLean, M.H., et al., Does the microbiota play a role in the pathogenesis of autoimmune diseases? Gut, 2014: p. gutjnl-2014-308514.
- Rajilic-Stojanovic, M., et al., Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology, 2011. 141(5): p. 1792-801.
- Saulnier, D.M., et al., The intestinal microbiome, probiotics and prebiotics in neurogastroenterology. Gut Microbes, 2013. 4(1): p. 17-27.
- Parkes, G.C., et al., Distinct microbial populations exist in the mucosa-associated microbiota of sub-groups of irritable bowel syndrome. Neurogastroenterology & Motility, 2012. 24(1): p. 31-39.
- Sundin, J., et al., Altered faecal and mucosal microbial composition in post-infectious irritable bowel syndrome patients correlates with mucosal lymphocyte phenotypes and psychological distress. Aliment Pharmacol Ther, 2015. 41(4): p. 342-51.
- Chumpitazi, B.P., et al., Gut microbiota influences low fermentable substrate diet efficacy in children with irritable bowel syndrome. Gut microbes, 2014. 5(2): p. 165-175.
- Qin, J., et al., A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012. 490(7418): p. 55-60.
- Cotillard, A., et al., Dietary intervention impact on gut microbial gene richness. Nature, 2013. 500(7464): p. 585-8.
- Wu, G.D., et al., Linking long-term dietary patterns with gut microbial enterotypes. Science, 2011. 334(6052): p. 105-108.
- Shen, Q., L. Zhao, and K.M. Tuohy, High-level dietary fibre up-regulates colonic fermentation and relative abundance of saccharolytic bacteria within the human faecal microbiota in vitro. European journal of nutrition, 2012. 51(6): p. 693-705.
- Vrieze, A., et al., Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology, 2012. 143(4): p. 913-6.e7.
www.drschaer-institute.com
