Il microbiota intestinale in soggetti sani e malati

In questo studio si evidenzia che una dieta bilanciata ricca di tutte le categorie di nutrienti dovrebbe servire a fornire un substrato alternato e sfavorire il proliferare di specie che potrebbero sortire effetti dannosi alla salute qualora prendessero il sopravvento nell’intestino.
L’emergere di nuove evidenze scientifiche e il perfezionamento delle tecniche d’analisi hanno permesso di acquisire maggiori informazioni sui batteri che popolano il nostro intestino. È ormai lampante come il tipo e la quantità di batteri presenti nel nostro intestino giochi un ruolo determinante per la nostra salute. Le aziende biotech stanno investendo sempre più in tecnologie che individuano in questo “microbioma” un potenziale moderatore del nostro benessere intestinale e del nostro sistema immunitario innato. La crescente incidenza delle patologie immuno-mediate e dei disturbi neurologici non si lascia spiegare da mutazioni nella genetica umana. [1] La disbiosi e la ridotta diversità batterica vengono comunemente ricondotte a queste patologie quando analizziamo il nostro “genoma alternativo” in cerca di risposte. Gli studi nel campo della metagenomica hanno permesso di appurare che una grande biodiversità batterica e la “ricchezza genetica” sono associate a un buono stato di salute.
INFO Terminologia di base
- Microbioma: l’insieme microrganismi che popolano il tratto intestinale.
- Disbiosi: proliferazione di uno o più organismi microbici potenzialmente dannosi per la biodiversità batterica e la salute dell’intestino. [3]
- Metagenomica: la disciplina che compara i genomi.
- Phyla: termine che in tassonomia allude alla suddivisione degli organismi in grandi gruppi sulla base di proprietà simili.
- Enterotipo: una categoria che consente di suddividere gli esseri umani in gruppi sulla base del tipo di batteri presenti nell’intestino.
- Transcrittoma: espressione dei geni sotto forma di proteine i.e. la parte attiva del genoma.
Quali specie compongono il microbioma?
Benché vi sia una grande varietà inter-individuale a livello di specie – nella maggior parte delle persone il microbiota intestinale è composto da circa 160 specie delle 1000 esistenti – non sono molti i phyla presenti nel microbioma. Qin et al. (2010) hanno identificato un nucleo di batteri comuni a tutte le persone. Lo studio del microbioma umano ha permesso di configurare tre principali enterotipi. [2] I generi dei batteri usati come marker per stabilire a quale categoria appartiene il microbioma di un individuo sono Bacteroides, Prevotella e Ruminococcus (l’ultimo gruppo è associato anche alla presenza del Methanobrevibacter). [1]
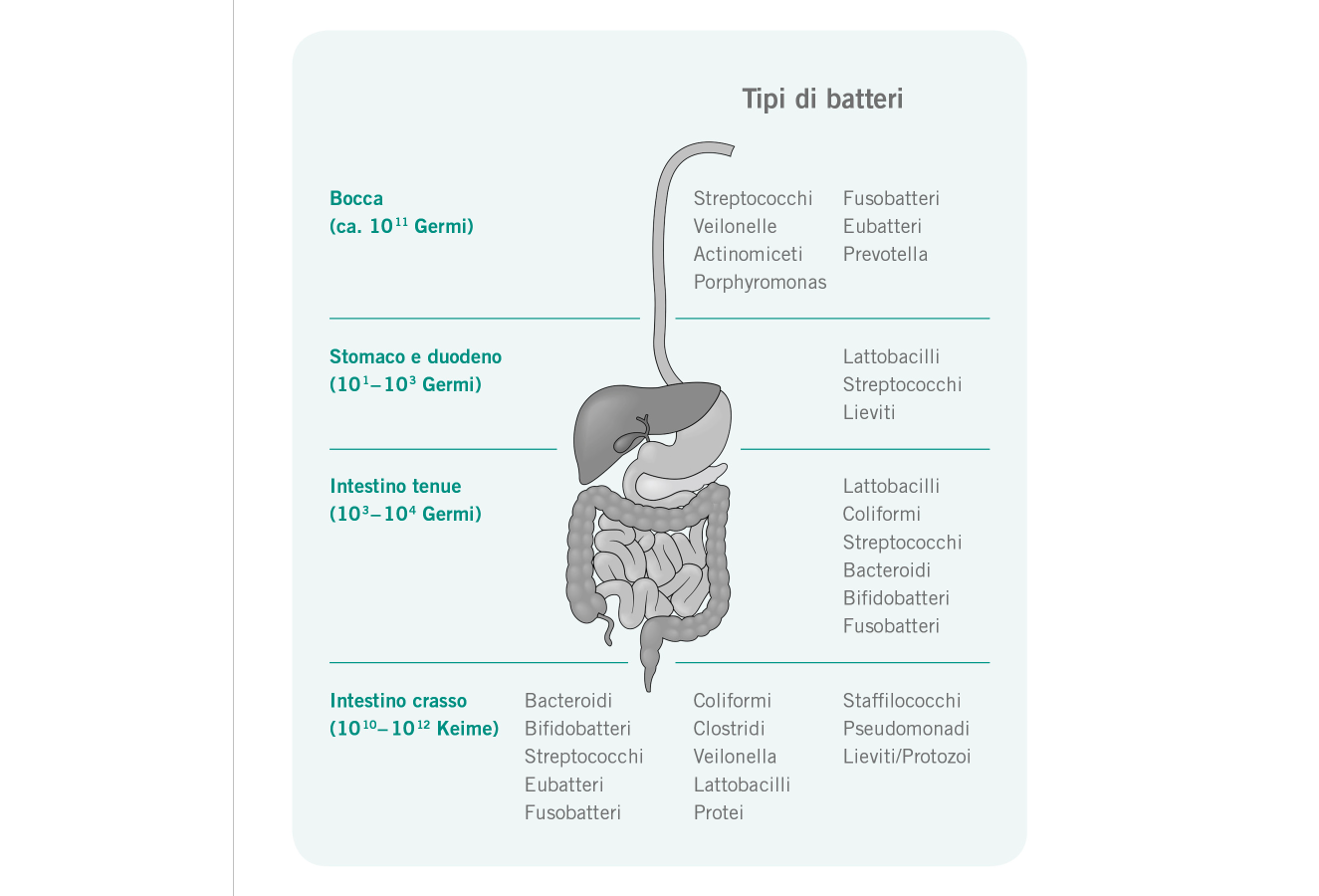
Funzione
Ancora non è stata fatta piena luce sulle funzioni del microbiota intestinale, ma alcuni dei suoi tratti caratteristici sono: segnalazione immunitaria e modulazione della risposta immunitaria; produzione di messaggeri del sistema nervoso; produzione di vitamine essenziali, regolazione del metabolismo lipidico; produzione di acidi grassi a catena corta (SCFA), in particolare butirrato, e acidi grassi a catena ramificata. A seconda del substrato fermentato, tra gli altri prodotti del microbioma figurano idrogeno, anidride carbonica e metano, ammoniaca, ammine e composti fenolici. [3]
La simbiosi tra l’organismo umano e il microbiota intestinale è sempre più evidente. Il termine “super-organismo” è stato coniato quando si è cominciato a considerare il nostro corpo come un organismo, un conglomerato del nostro trascrittoma sommato al tascrittoma plastico e molto più ampio del microbiota intestinale. Il corredo genetico dei batteri che popolano il tratto intestinale è 100 volte più grande del nostro. [4] Pertanto non sorprende che l’attenzione nello studio delle cause, della prevenzione e della cura delle patologie sia ora rivolta a questo “genoma alternativo”.
Il sistema nervoso enterico (SNE) è talvolta definito in letteratura come il “secondo cervello”. Ciò è dovuto al fatto che è composto da più di 200 milioni di neuroni. [5] Il SNE invia segnali dall’intestino al cervello mediante un sistema di segnalazioni endocrino, neuronale e immunitario. [5] Inoltre il tessuto linfoide associato all’intestino (GALT) che regolarmente seleziona e risponde ai segnali provenienti dal lume intestinale è considerato l’organo di difesa contro le infezioni più esteso del corpo umano. [5]
La combinazione delle interazioni tra lo SNE, il microbioma e il GALT mostra un grande potenziale per influire positivamente sul benessere fisico, immunologico ed emotivo.
La simbiosi tra l’organismo umano e il microbiota intestinale è sempre più evidente. Il termine “super-organismo” è stato coniato quando si è cominciato a considerare il nostro corpo come un organismo, un conglomerato del nostro trascrittoma sommato al tascrittoma plastico e molto più ampio del microbiota intestinale. Il corredo genetico dei batteri che popolano il tratto intestinale è 100 volte più grande del nostro. [4] Pertanto non sorprende che l’attenzione nello studio delle cause, della prevenzione e della cura delle patologie sia ora rivolta a questo “genoma alternativo”.
Il sistema nervoso enterico (SNE) è talvolta definito in letteratura come il “secondo cervello”. Ciò è dovuto al fatto che è composto da più di 200 milioni di neuroni. [5] Il SNE invia segnali dall’intestino al cervello mediante un sistema di segnalazioni endocrino, neuronale e immunitario. [5] Inoltre il tessuto linfoide associato all’intestino (GALT) che regolarmente seleziona e risponde ai segnali provenienti dal lume intestinale è considerato l’organo di difesa contro le infezioni più esteso del corpo umano. [5]
La combinazione delle interazioni tra lo SNE, il microbioma e il GALT mostra un grande potenziale per influire positivamente sul benessere fisico, immunologico ed emotivo.
Da che cosa è formato il microbioma?
Il microbioma inizia a formarsi alla nascita. Il parto e la nutrizione del neonato influiscono sullo sviluppo iniziale del microbioma. Si ritiene che lo svezzamento e l’ambiente (rurale o urbano) in cui viene allevato il bambino influenzino il microbioma maturo. Studi condotti su comunità isolate dell’Africa hanno evidenziato la presenza di una colonizzazione batterica unica e diversa da quella riscontrata in un gruppo occidentale, a riprova di quanto l’ambiente rappresenti una grande spinta alla colonizzazione. [6] Studi sui gemelli hanno rivelato che esiste una marcata influenza genetica sulla varietà delle specie, almeno nel caso di alcuni taxa. [7] Anche i partner di gemelli monozigoti mostravano correlazioni positive, avvalorando l’ipotesi che la natura e l’alimentazione siano fattori importanti nel determinare la ricchezza genetica del microbiota intestinale. [8]
Negli anziani il microbioma cambia di nuovo, anche se non è chiaro il motivo per cui ciò accada. Nella popolazione anziana si osserva una riduzione nel numero di batteri che producono butirrato e una riduzione nella ricchezza genetica del microbioma. Gli anziani che vivono all’interno della comunità conservano una maggiore ricchezza genetica, presumibilmente il risultato di una dieta più varia, rispetto ad anziani internati in strutture di cura a lungo termine. [9]
Negli anziani il microbioma cambia di nuovo, anche se non è chiaro il motivo per cui ciò accada. Nella popolazione anziana si osserva una riduzione nel numero di batteri che producono butirrato e una riduzione nella ricchezza genetica del microbioma. Gli anziani che vivono all’interno della comunità conservano una maggiore ricchezza genetica, presumibilmente il risultato di una dieta più varia, rispetto ad anziani internati in strutture di cura a lungo termine. [9]
Come influisce su di noi il cambiamento?
La disbiosi è associata a numerose patologie. [3] Recentemente è stato pubblicato un elenco delle malattie e delle alterazioni nelle popolazioni batteriche a esse correlate. [4] Le nuove tecnologie hanno permesso di identificare una sorta di “impronta digitale batterica” legata a determinate patologie che potrebbe rivelarsi un potente e non invasivo strumento diagnostico permettendo lo sviluppo di una terapia specifica.
Alcuni studi sull’obesità hanno mostrato che i soggetti caratterizzati da una ridotta ricchezza genetica presentavano una maggiore adiposità globale, insulino-resistenza e dislipidemia oltre a un fenotipo infiammatorio più marcato. [10] Una minore ricchezza genetica portava nel tempo a un aumento di peso. Goodrich et al. (2014) hanno dimostrato l’ereditarietà di un microbioma obesogenico e hanno ipotizzato una correlazione tra i batteri metanogeni appartenenti alla specie Christensenella e i disturbi metabolici.
Studi su bambini che mostrano una predisposizione genetica alla malattia celiaca (CoD) evidenziano una carenza di Actinobacteria (inclusi Bifidobacteria) e una proliferazione di Firmicutes e Proteobacteria. [11] Va detto comunque che non è ancora stata provata in via definitiva l’esistenza di una correlazione immediata tra le alterazioni microbiche e l’insorgenza della patologia celiaca. [12]
Il sequenziamento del microbioma in persone affette da sindrome dell’intestino irritabile (IBS) ha rivelato una disbiosi. [13] Ulteriori studi hanno messo in luce le differenze nei batteri che popolano il lume e le mucose intestinali in pazienti affetti da sottotipi di IBS. [14,16]
Un recente studio pilota sul microbioma in ambito pediatrico consiglia l’adozione della FODMAP, la dieta a basso contenuto di carboidrati, per alleviare i sintomi della malattia. [17]
Qin et al. (2012) hanno studiato le dinamiche antagonistiche tra batteri benefici e dannosi nel diabete di tipo 2. Una diminuzione dei batteri che producono butirrato sarebbe indice di un rischio elevato nello sviluppo di patologie correlate all’obesità. [18]
Alcuni studi sull’obesità hanno mostrato che i soggetti caratterizzati da una ridotta ricchezza genetica presentavano una maggiore adiposità globale, insulino-resistenza e dislipidemia oltre a un fenotipo infiammatorio più marcato. [10] Una minore ricchezza genetica portava nel tempo a un aumento di peso. Goodrich et al. (2014) hanno dimostrato l’ereditarietà di un microbioma obesogenico e hanno ipotizzato una correlazione tra i batteri metanogeni appartenenti alla specie Christensenella e i disturbi metabolici.
Studi su bambini che mostrano una predisposizione genetica alla malattia celiaca (CoD) evidenziano una carenza di Actinobacteria (inclusi Bifidobacteria) e una proliferazione di Firmicutes e Proteobacteria. [11] Va detto comunque che non è ancora stata provata in via definitiva l’esistenza di una correlazione immediata tra le alterazioni microbiche e l’insorgenza della patologia celiaca. [12]
Il sequenziamento del microbioma in persone affette da sindrome dell’intestino irritabile (IBS) ha rivelato una disbiosi. [13] Ulteriori studi hanno messo in luce le differenze nei batteri che popolano il lume e le mucose intestinali in pazienti affetti da sottotipi di IBS. [14,16]
Un recente studio pilota sul microbioma in ambito pediatrico consiglia l’adozione della FODMAP, la dieta a basso contenuto di carboidrati, per alleviare i sintomi della malattia. [17]
Qin et al. (2012) hanno studiato le dinamiche antagonistiche tra batteri benefici e dannosi nel diabete di tipo 2. Una diminuzione dei batteri che producono butirrato sarebbe indice di un rischio elevato nello sviluppo di patologie correlate all’obesità. [18]
Come possiamo migliorare il microbioma?
Diversi studi sull’alimentazione dimostrano che cambiare dieta permette di alterare il microbioma, [19] a riprova delle grandi potenzialità di questo ambito di ricerca. Nutrire l’ospite per nutrire il microbiota è la strategia di manipolazione più ovvia del microbiota. Una dieta ad alto contenuto proteico e lipidico è stata associata all’enterotipo Bacteroides, mentre una dieta ricca di carboidrati corrisponde all’enterotipo Prevotella. [20] È stato dimostrato che cambiamenti a breve termine nella dieta (10 giorni) sono in grado di modificare la composizione del microbioma ma non alterano l’enterotipo. Una dieta ad alto contenuto di fibre induce una proliferazione di tre gruppi batterici solitamente associati a uno stato di buona salute, Faecalibaterium prausnitzii, Bifidobacterium e Clostridium cluster XIVa. [1,21]
Altri studi sono concordi nel sancire l’utilità di prebiotici e probiotici nel favorire la diffusione dei benefici bifidobatteri e lactobacilli. Inoltre sono stati chiariti i meccanismi grazie ai quali specie diverse di Lactobacilli e Bifidobacteria non solo sortiscono effetti benefici sull’ospite, ma inibiscono la proliferazione e l’attività di enteropatogeni aggressivi (cfr.). [4] Esiste l’eventualità che in futuro altri ceppi batterici (es. Akkermansia mucinophila e Christensenella minuta) saranno introdotti in prebiotici e probiotici. [4]
Il trapianto di microbiota fecale è un’altra tecnica che consente di operare una rapida correzione di un microbioma alterato. Studi clinici condotti su pazienti affetti da Clostridium difficile non trattabile hanno dato risultati incoraggianti. Il trapianto di microbiota fecale da donatori sani ha indotto un aumento nella resistenza all’insulina da parte di pazienti affetti da sindrome metabolica [22] – fornendo un riscontro alla teoria secondo cui la disbiosi gioca un ruolo importante nello sviluppo dei disturbi legati all’obesità.
Strategie antimicrobiche per la modulazione del microbioma potrebbero avere un potenziale terapeutico in futuro, anche se allo stadio attuale la ricerca ne ha testato l’efficacia solo sui topi. Al momento non se ne raccomanda l’attuazione. [4]
Una dieta varia e bilanciata ricca di tutte le categorie di nutrienti dovrebbe servire a fornire un substrato alternato e sfavorire il proliferare di specie che potrebbero sortire effetti dannosi alla salute se prendono il sopravvento nell’intestino. Alterazioni nel microbioma causate da antibiotici o da attacchi di gastroenterite rendono consigliabile l’impiego generico di prebiotici e probiotici senza temere l’insorgenza di effetti collaterali. La coprocultura, un esame utile a verificare una ridotta biodiversità batterica, può rivelarsi uno strumento diagnostico utile a effettuare una diagnosi precoce di alcune patologie permettendo di adottare misure preventive.
Altri studi sono concordi nel sancire l’utilità di prebiotici e probiotici nel favorire la diffusione dei benefici bifidobatteri e lactobacilli. Inoltre sono stati chiariti i meccanismi grazie ai quali specie diverse di Lactobacilli e Bifidobacteria non solo sortiscono effetti benefici sull’ospite, ma inibiscono la proliferazione e l’attività di enteropatogeni aggressivi (cfr.). [4] Esiste l’eventualità che in futuro altri ceppi batterici (es. Akkermansia mucinophila e Christensenella minuta) saranno introdotti in prebiotici e probiotici. [4]
Il trapianto di microbiota fecale è un’altra tecnica che consente di operare una rapida correzione di un microbioma alterato. Studi clinici condotti su pazienti affetti da Clostridium difficile non trattabile hanno dato risultati incoraggianti. Il trapianto di microbiota fecale da donatori sani ha indotto un aumento nella resistenza all’insulina da parte di pazienti affetti da sindrome metabolica [22] – fornendo un riscontro alla teoria secondo cui la disbiosi gioca un ruolo importante nello sviluppo dei disturbi legati all’obesità.
Strategie antimicrobiche per la modulazione del microbioma potrebbero avere un potenziale terapeutico in futuro, anche se allo stadio attuale la ricerca ne ha testato l’efficacia solo sui topi. Al momento non se ne raccomanda l’attuazione. [4]
Una dieta varia e bilanciata ricca di tutte le categorie di nutrienti dovrebbe servire a fornire un substrato alternato e sfavorire il proliferare di specie che potrebbero sortire effetti dannosi alla salute se prendono il sopravvento nell’intestino. Alterazioni nel microbioma causate da antibiotici o da attacchi di gastroenterite rendono consigliabile l’impiego generico di prebiotici e probiotici senza temere l’insorgenza di effetti collaterali. La coprocultura, un esame utile a verificare una ridotta biodiversità batterica, può rivelarsi uno strumento diagnostico utile a effettuare una diagnosi precoce di alcune patologie permettendo di adottare misure preventive.
Autore
BRIDGETTE WILSON BSC, MSC, PGDIP, RD.
Dietista ricercatore del King’s College di Londra. Bridgette è titolare di un dottorato di ricerca presso il King’s College di Londra ed esercita la professione di dietista. Ha conseguito un Bachelor of Biological Sciences e un Master in biologia molecolare prima di intraprendere la formazione di dietista. Facendo tesoro dell’esperienza conseguita lavorando nel NHS, il sistema sanitario nazionale britannico, Bridgette ha intrapreso un nuovo progetto di ricerca in gastroenterologia. Attualmente lavora nel team del professor Kevin Whelan e della dottoressa Miranda Lomer presso il King’s College di Londra e sta creando un protocollo dietetico specifico per la sindrome dell’intestino irritabile.
Dietista ricercatore del King’s College di Londra. Bridgette è titolare di un dottorato di ricerca presso il King’s College di Londra ed esercita la professione di dietista. Ha conseguito un Bachelor of Biological Sciences e un Master in biologia molecolare prima di intraprendere la formazione di dietista. Facendo tesoro dell’esperienza conseguita lavorando nel NHS, il sistema sanitario nazionale britannico, Bridgette ha intrapreso un nuovo progetto di ricerca in gastroenterologia. Attualmente lavora nel team del professor Kevin Whelan e della dottoressa Miranda Lomer presso il King’s College di Londra e sta creando un protocollo dietetico specifico per la sindrome dell’intestino irritabile.
Riferimento bibliografico
- Blottiere, H.M., et al., Human intestinal metagenomics: state of the art and future. Curr Opin Microbiol, 2013. 16(3): p. 232-9.
- Qin, J., et al., A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 2010. 464(7285): p. 59-65.
- Roberfroid, M., et al., Prebiotic effects: metabolic and health benefits. British Journal of Nutrition, 2010. 104(S2): p. S1-S63.
- Walsh, C.J., et al., Beneficial modulation of the gut microbiota. FEBS letters, 2014. 588(22): p. 4120-4130.
- Al Omran, Y. and Q. Aziz, The brain-gut axis in health and disease, in Microbial Endocrinology: The Microbiota-Gut-Brain Axis in Health and Disease. 2014, Springer. p. 135-153.
- De Filippo, C., et al., Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proceedings of the National Academy of Sciences, 2010. 107(33): p. 14691-14696.
- Goodrich, J.K., et al., Human genetics shape the gut microbiome. Cell, 2014. 159(4): p. 789-799.
- Nelson, K.E., et al., Metagenomics of the human body. 2011: Springer.
- Claesson, M.J., et al., Composition, variability, and temporal stability of the intestinal microbiota of the elderly. Proceedings of the National Academy of Sciences, 2011. 108(Supplement 1): p. 4586-4591.
- Le Chatelier, E., et al., Richness of human gut microbiome correlates with metabolic markers. Nature, 2013. 500(7464): p. 541-546.
- Olivares, M., et al., The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut, 2014: p. gutjnl-2014-306931.
- McLean, M.H., et al., Does the microbiota play a role in the pathogenesis of autoimmune diseases? Gut, 2014: p. gutjnl-2014-308514.
- Rajilic-Stojanovic, M., et al., Global and deep molecular analysis of microbiota signatures in fecal samples from patients with irritable bowel syndrome. Gastroenterology, 2011. 141(5): p. 1792-801.
- Saulnier, D.M., et al., The intestinal microbiome, probiotics and prebiotics in neurogastroenterology. Gut Microbes, 2013. 4(1): p. 17-27.
- Parkes, G.C., et al., Distinct microbial populations exist in the mucosa-associated microbiota of subgroups of irritable bowel syndrome. Neurogastroenterology & Motility, 2012. 24(1): p. 31-39.
- Sundin, J., et al., Altered faecal and mucosal microbial composition in post-infectious irritable bowel syndrome patients correlates with mucosal lymphocyte phenotypes and psychological distress. Aliment Pharmacol Ther, 2015. 41(4): p. 342-51.
- Chumpitazi, B.P., et al., Gut microbiota influences low fermentable substrate diet efficacy in children with irritable bowel syndrome. Gut microbes, 2014. 5(2): p. 165-175.
- Qin, J., et al., A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature, 2012. 490(7418): p. 55-60.
- Cotillard, A., et al., Dietary intervention impact on gut microbial gene richness. Nature, 2013. 500(7464): p. 585-8.
- Wu, G.D., et al., Linking long-term dietary patterns with gut microbial enterotypes. Science, 2011. 334(6052): p. 105-108.
- Shen, Q., L. Zhao, and K.M. Tuohy, High-level dietary fibre up-regulates colonic fermentation and relative abundance of saccharolytic bacteria within the human faecal microbiota in vitro. European journal of nutrition, 2012. 51(6): p. 693-705.
- Vrieze, A., et al., Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology, 2012. 143(4): p. 913-6.e7.
www.drschaer-institute.com
