Il ruolo del microbioma nelle malattie associate al glutine

Alcuni studiosi ritengono che una delle cause delle intolleranze alimentari sia da ricercarsi nelle alterazioni della flora intestinale, in quanto la compromessa integrità della barriera esporrebbe al rischio di sviluppare una permeabilità intestinale.
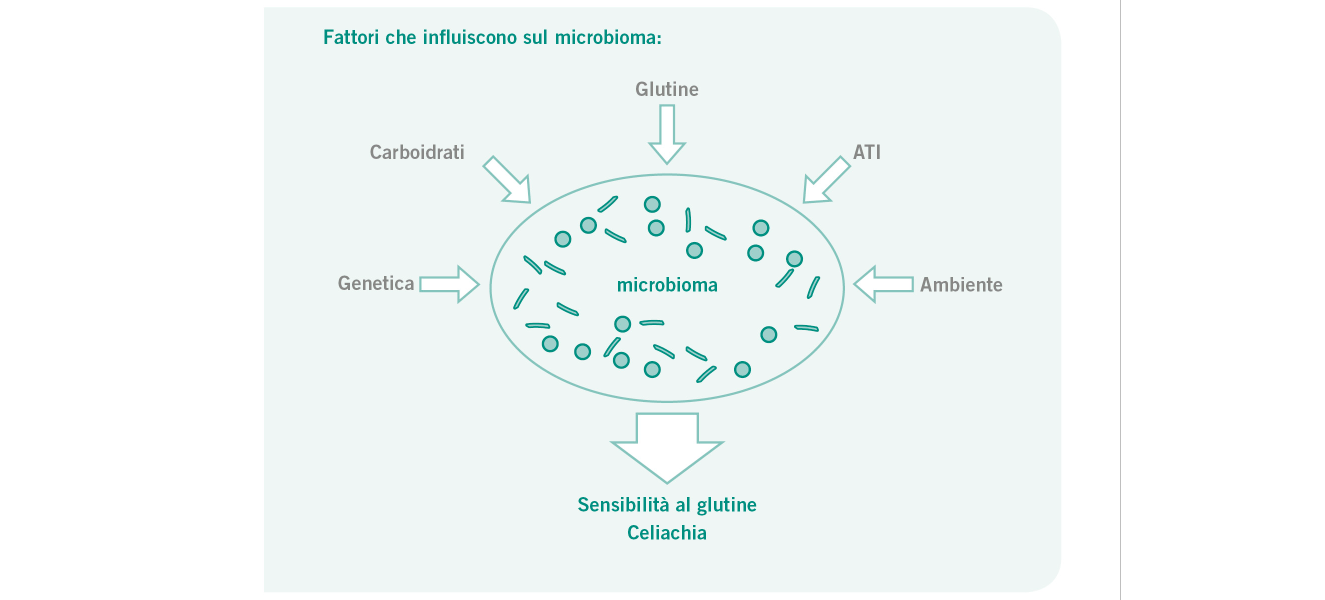
La crescente diffusione delle intolleranze alimentari, in particolare verso determinati carboidrati, rappresenta un problema di salute globale. [1] L’intolleranza al glutine e alle sostanze associate al glutine come gli inibitori dell’amilasi/tripsina (ATI) è ritenuta responsabile [2] dei disturbi intestinali (es. meteorismo, dolori, costipazione, diarrea) ed extra-intestinali (es. affaticamento, emicrania, dolori articolari, irritazioni alla pelle) che affliggono i pazienti. [3] Attualmente si ritiene che una delle cause delle intolleranze alimentari sia da ricercarsi nelle alterazioni della flora intestinale e nei loro effetti sulla tolleranza immunologica a livello della mucosa intestinale. [4]
Una barriera intestinale integra è fondamentale per mantenere l’omeostasi dell’intestino. Uno squilibrio intestinale che comprometta l’integrità della barriera ci espone al rischio di sviluppare una permeabilità intestinale (Leaky-Gut Syndrom). La correlazione tra la permeabilità della barriera intestinale e l’insorgenza di intolleranze alimentari e di patologie a carico dello stomaco e dell’intestino è ormai assodata. [5]
Il microbioma dell’apparato digerente influenza in maniera significativa il decorso di patologie associate al frumento e al glutine. [4]
È risaputo che il benessere della microflora intestinale è legato a molti fattori. La composizione microbica nell’intestino tenue è il risultato della competizione che si instaura tra i microorganismi e l’organismo ospite nell’assorbire e assimilare più rapidamente i carboidrati. I microrganismi del colon, invece, risentono del complesso procedimento di assimilazione dei carboidrati e della concorrenza reciproca. [6]
L’alimentazione è determinante. Sperimentazioni condotte sui topi hanno permesso di appurare che l’adozione di un particolare regime dietetico ha rapidi effetti sulla composizione microbica dell’intestino. [7]
Numerose pubblicazioni documentano la presenza di Streptococcus sp, E. coli, Clostridium sp, organismi ad alto contenuto di G+C, Bacteroides uniformis, Blautia glucerasea e bifidobatteri nell’intestino tenue e nell’intestino crasso, che prediligono substrati diversi. [8] È interessante osservare a questo proposito che B.uniformis assimila principalmente l’inulina, mentre le altre specie metabolizzano soprattutto fruttoligosaccaridi e monosaccaridi. [9]
Quanto sia determinante la composizione microbica nella celiachia è dimostrato dal fatto che nei pazienti affetti da questa patologia si sviluppa una popolazione batterica diversa da quella dei soggetti sani. Nei pazienti celiaci è stata riscontrata una proliferazione di Bifidobacterium bifidum e di Lactobacillus sp.; una differenza che si attenua nettamente con l’adozione di una dieta priva glutine. [10] Più di una sperimentazione in vitro ha permesso di provare che alcuni ceppi di bifidobatteri sono in grado di attenuare la risposta immunitaria potenzialmente infiammatoria innescata dai peptidi della gliadina, esercitando così un effetto protettivo. [11,12]
Nel 2013 Wacklin et al. hanno ipotizzato una correlazione tra la manifestazione della celiachia sotto forma di sintomi gastrointestinali o extra-intestinali e il microbioma. [13]
Uno studio successivo ha confrontato il microbioma duodenale di un paziente affetto da celiachia che presentava sintomi persistenti pur avendo adottato da molto tempo una dieta priva di glutine con la mucosa dell’intestino tenue normalizzata di una persona affetta da celiachia asintomatica. La comparazione ha evidenziato una diversa colonizzazione batterica nell’intestino tenue dei pazienti con sintomi persistenti rispetto ai pazienti asintomatici. Vi erano elevati livelli di Proteobacteria, a fronte di un numero ridotto di Bacteroides e di Firmicutes. Nel complesso, i pazienti celiaci con sintomi persistenti mostravano una ridotta ricchezza microbica. In alcuni sottogruppi di celiachia si identifica la disbiosi come possibile origine della sintomatologia, aprendo la strada ad approcci terapeutici alternativi alla malattia che prevedano la somministrazione di probiotici e prebiotici. [14]
Smecuol et al. hanno studiato gli effetti del probiotico Bifidobacterium infantis Natren Life Start Super Strain sul decorso clinico di pazienti celiaci non trattati. 12 dei 22 pazienti hanno assunto 2 capsule di B. infantis mentre a 10 pazienti sono state somministrate 2 capsule di placebo a stomaco pieno. Se il probiotico non sortiva alcun effetto sulla permeabilità intestinale, nel gruppo che ha assunto B. infantis si è assistito a un netto miglioramento dei sintomi tra cui dispepsia, stipsi e reflusso. Inoltre nel gruppo del probiotico si è verificato un significativo aumento di MIP-1ß (proteina infiammatoria macrofaga 1ß). Questo studio sembrerebbe suggerire un effetto attenuante del probiotico su alcuni sintomi della celiachia da confermare con ulteriori ricerche. [15]
Uno studio attualmente in corso di Olivares et al. su pazienti che mostrano un’alta predisposizione genetica alla celiachia ha dimostrato la presenza di una composizione microbica alterata già in età neonatale e infantile, a riprova dell’insorgenza precoce di tali alterazioni. In confronto ai neonati non esposti a un elevato rischio di celiachia, nei portatori HLA-DQ2 positivi si è riscontrata la netta proliferazione di Firmicutes e Proteobacteria a fronte di una carenza di Actinobacteria. Anche i bifidobatteri erano rappresentati da un numero limitato di specie. Una predisposizione genetica nei soggetti HLA-DQ2 positivi parrebbe avere qualche effetto sul microbioma e portare all’insorgenza della patologia, una cognizione che potrebbe rivelarsi utile nello stabilire il rischio di celiachia. [16] Nel complesso questi dati dimostrano l’esistenza di una correlazione tra l’insorgenza e la sintomatologia delle patologie legate al glutine e il microbioma umano. È ancora tutto da verificare mediante ricerche approfondite se alcune specie batteriche siano attivamente coinvolte nella patogenesi della celiachia o della sensibilità al glutine (NCGS), oppure se si limitino a beneficiare di condizioni di vita particolarmente favorevoli conseguenti al danneggiamento della barriera intestinale.
I primi dati di Biesiekierski et al. (2013) portano a supporre che anche nei pazienti allergici al frumento, i carboidrati in fermentazione inneschino o quantomeno influiscano sulla sintomatologia. Per questo motivo riteniamo che determinare la colonizzazione microbica sia estremamente utile al fine di comprendere eventuali differenze tra questi pazienti e i soggetti sani del gruppo di controllo.
Nell’ambito di uno studio prospettico controllato stiamo analizzando le alterazioni della microflora intestinale in pazienti che mostrano un’allergia conclamata al frumento sottoponendoli a una dieta bilanciata, gluten-free e povera di carboidrati (FODMAP) per accertare gli effetti delle catene di carboidrati sulla proliferazione e sulla differenziazione batterica. Il confronto con un gruppo di controllo sano e una popolazione di controllo affetta da celiachia conclamata consentirà di comprendere quali ceppi batterici siano in grado di scatenare l’allergia al frumento.
Riuscire a dimostrare l’esistenza di una composizione della flora intestinale specifica in pazienti allergici al frumento potrebbe aprire la strada a un approccio innovativo per una terapia probiotica mirata e priva di effetti collaterali.
Una barriera intestinale integra è fondamentale per mantenere l’omeostasi dell’intestino. Uno squilibrio intestinale che comprometta l’integrità della barriera ci espone al rischio di sviluppare una permeabilità intestinale (Leaky-Gut Syndrom). La correlazione tra la permeabilità della barriera intestinale e l’insorgenza di intolleranze alimentari e di patologie a carico dello stomaco e dell’intestino è ormai assodata. [5]
Il microbioma dell’apparato digerente influenza in maniera significativa il decorso di patologie associate al frumento e al glutine. [4]
È risaputo che il benessere della microflora intestinale è legato a molti fattori. La composizione microbica nell’intestino tenue è il risultato della competizione che si instaura tra i microorganismi e l’organismo ospite nell’assorbire e assimilare più rapidamente i carboidrati. I microrganismi del colon, invece, risentono del complesso procedimento di assimilazione dei carboidrati e della concorrenza reciproca. [6]
L’alimentazione è determinante. Sperimentazioni condotte sui topi hanno permesso di appurare che l’adozione di un particolare regime dietetico ha rapidi effetti sulla composizione microbica dell’intestino. [7]
Numerose pubblicazioni documentano la presenza di Streptococcus sp, E. coli, Clostridium sp, organismi ad alto contenuto di G+C, Bacteroides uniformis, Blautia glucerasea e bifidobatteri nell’intestino tenue e nell’intestino crasso, che prediligono substrati diversi. [8] È interessante osservare a questo proposito che B.uniformis assimila principalmente l’inulina, mentre le altre specie metabolizzano soprattutto fruttoligosaccaridi e monosaccaridi. [9]
Quanto sia determinante la composizione microbica nella celiachia è dimostrato dal fatto che nei pazienti affetti da questa patologia si sviluppa una popolazione batterica diversa da quella dei soggetti sani. Nei pazienti celiaci è stata riscontrata una proliferazione di Bifidobacterium bifidum e di Lactobacillus sp.; una differenza che si attenua nettamente con l’adozione di una dieta priva glutine. [10] Più di una sperimentazione in vitro ha permesso di provare che alcuni ceppi di bifidobatteri sono in grado di attenuare la risposta immunitaria potenzialmente infiammatoria innescata dai peptidi della gliadina, esercitando così un effetto protettivo. [11,12]
Nel 2013 Wacklin et al. hanno ipotizzato una correlazione tra la manifestazione della celiachia sotto forma di sintomi gastrointestinali o extra-intestinali e il microbioma. [13]
Uno studio successivo ha confrontato il microbioma duodenale di un paziente affetto da celiachia che presentava sintomi persistenti pur avendo adottato da molto tempo una dieta priva di glutine con la mucosa dell’intestino tenue normalizzata di una persona affetta da celiachia asintomatica. La comparazione ha evidenziato una diversa colonizzazione batterica nell’intestino tenue dei pazienti con sintomi persistenti rispetto ai pazienti asintomatici. Vi erano elevati livelli di Proteobacteria, a fronte di un numero ridotto di Bacteroides e di Firmicutes. Nel complesso, i pazienti celiaci con sintomi persistenti mostravano una ridotta ricchezza microbica. In alcuni sottogruppi di celiachia si identifica la disbiosi come possibile origine della sintomatologia, aprendo la strada ad approcci terapeutici alternativi alla malattia che prevedano la somministrazione di probiotici e prebiotici. [14]
Smecuol et al. hanno studiato gli effetti del probiotico Bifidobacterium infantis Natren Life Start Super Strain sul decorso clinico di pazienti celiaci non trattati. 12 dei 22 pazienti hanno assunto 2 capsule di B. infantis mentre a 10 pazienti sono state somministrate 2 capsule di placebo a stomaco pieno. Se il probiotico non sortiva alcun effetto sulla permeabilità intestinale, nel gruppo che ha assunto B. infantis si è assistito a un netto miglioramento dei sintomi tra cui dispepsia, stipsi e reflusso. Inoltre nel gruppo del probiotico si è verificato un significativo aumento di MIP-1ß (proteina infiammatoria macrofaga 1ß). Questo studio sembrerebbe suggerire un effetto attenuante del probiotico su alcuni sintomi della celiachia da confermare con ulteriori ricerche. [15]
Uno studio attualmente in corso di Olivares et al. su pazienti che mostrano un’alta predisposizione genetica alla celiachia ha dimostrato la presenza di una composizione microbica alterata già in età neonatale e infantile, a riprova dell’insorgenza precoce di tali alterazioni. In confronto ai neonati non esposti a un elevato rischio di celiachia, nei portatori HLA-DQ2 positivi si è riscontrata la netta proliferazione di Firmicutes e Proteobacteria a fronte di una carenza di Actinobacteria. Anche i bifidobatteri erano rappresentati da un numero limitato di specie. Una predisposizione genetica nei soggetti HLA-DQ2 positivi parrebbe avere qualche effetto sul microbioma e portare all’insorgenza della patologia, una cognizione che potrebbe rivelarsi utile nello stabilire il rischio di celiachia. [16] Nel complesso questi dati dimostrano l’esistenza di una correlazione tra l’insorgenza e la sintomatologia delle patologie legate al glutine e il microbioma umano. È ancora tutto da verificare mediante ricerche approfondite se alcune specie batteriche siano attivamente coinvolte nella patogenesi della celiachia o della sensibilità al glutine (NCGS), oppure se si limitino a beneficiare di condizioni di vita particolarmente favorevoli conseguenti al danneggiamento della barriera intestinale.
I primi dati di Biesiekierski et al. (2013) portano a supporre che anche nei pazienti allergici al frumento, i carboidrati in fermentazione inneschino o quantomeno influiscano sulla sintomatologia. Per questo motivo riteniamo che determinare la colonizzazione microbica sia estremamente utile al fine di comprendere eventuali differenze tra questi pazienti e i soggetti sani del gruppo di controllo.
Nell’ambito di uno studio prospettico controllato stiamo analizzando le alterazioni della microflora intestinale in pazienti che mostrano un’allergia conclamata al frumento sottoponendoli a una dieta bilanciata, gluten-free e povera di carboidrati (FODMAP) per accertare gli effetti delle catene di carboidrati sulla proliferazione e sulla differenziazione batterica. Il confronto con un gruppo di controllo sano e una popolazione di controllo affetta da celiachia conclamata consentirà di comprendere quali ceppi batterici siano in grado di scatenare l’allergia al frumento.
Riuscire a dimostrare l’esistenza di una composizione della flora intestinale specifica in pazienti allergici al frumento potrebbe aprire la strada a un approccio innovativo per una terapia probiotica mirata e priva di effetti collaterali.
Autori
PROF. DR. MED. YURDAGÜL ZOPF
Responsabile della Medicina Nutrizionale clinica e sperimentale, Specialista in Medicina Interna, Dipartimento di Medicina Interna 1
PRIV. DOZ. DR. RER. NAT. WALBURGA DIETERICH
Ricercatore presso il Dipartimento di Medicina Interna 1, Kussmaul Campus per la ricerca medica
Responsabile della Medicina Nutrizionale clinica e sperimentale, Specialista in Medicina Interna, Dipartimento di Medicina Interna 1
PRIV. DOZ. DR. RER. NAT. WALBURGA DIETERICH
Ricercatore presso il Dipartimento di Medicina Interna 1, Kussmaul Campus per la ricerca medica
Riferimento bibliografico
- Zopf Y. et al., The differential diagnosis of food intolerance. Dtsch Arztebl Int. 2009 May;106(21):359-69;
- Junker Y. et al., Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med. 2012 Dec 17;209(13):2395-408.
- Volta U. et al., Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness. Cell Mol Immunol. 2013 Sep;10(5):38392.
- Galipeau HJ, Verdu EF. Gut microbes and adverse food reactions: Focus on gluten related disorders. Gut Microbes. 2014;5(5):594-605.
- Barbara G. et al., Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J Clin Gastroenterol. 2012 Oct;46 Suppl:S52-5.
- Zoetendal, E.G. and W.M. de Vos, Effect of diet on the intestinal microbiota and its activity. Curr Opin Gastroenterol, 2014.
- Ooi, J.H., et al., Dominant effects of the diet on the microbiome and the local and systemic immune response in mice. PLoS One, 2014. 9(1): p. e86366.
- Zoetendal, E.G., et al., The human small intestinal microbiota is driven by rapid uptake and conversion of simple carbohydrates. ISME J, 2012. 6(7): p. 1415-26.
- Tannock, G.W., et al., RNA-stable isotope probing (RNA-SIP) shows carbon utilization from inulin by specific bacterial populations in the large bowel of rats. Appl Environ Microbiol, 2014.
- Nistal, E., et al., Differences in faecal bacteria populations and faecal bacteria metabolism in healthy adults and celiac disease patients. Biochimie, 2012. 94(8): p. 1724-9.
- Medina, M., et al., Bifidobacterium strains suppress in vitro the pro-inflammatory milieu triggered by the large intestinal microbiota of coeliac patients. J Inflamm (Lond), 2008. 5: p. 19.
- Laparra, J.M. and Y. Sanz, Bifidobacteria inhibit the inflammatory response induced by gliadins in intestinal epithelial cells via modifications of toxic peptide generation during digestion. J Cell Biochem, 2010. 109(4): p. 801-7.
- Wacklin, P., et al., The duodenal microbiota composition of adult celiac disease patients is associated with the clinical manifestation of the disease. Inflamm Bowel Dis, 2013. 19(5): p. 934-41.
- Wacklin, P., et al., Altered duodenal microbiota composition in celiac disease patients suffering from persistent symptoms on a long-term gluten-free diet. Am J Gastroenterol, 2014. 109(12): p. 1933-41.
- Smecuol E, H.H., Sugai E, Corso L, Cherñavsky AC, Bellavite FP, González A, Vodánovich F, Moreno ML, Vázquez H, Lozano G, Niveloni S, Mazure R, Meddings J, Mauriño E, Bai JC., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol, 2013. 47: p. 139147.
- Olivares, M., et al., The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut, 2015. 64(3): p. 406-17.
www.drschaer-institute.com
