Influencia del microbioma en las enfermedades relacionadas con el gluten

Este breve artículo ofrece una visión general de las alteraciones que surgen en la microbiota a causa de los trastornos relacionados con el gluten, centrándose especialmente en la enfermedad celíaca. También se resaltan en los resultados de un estudio prospectivo controlado previsto que examina los cambios en la microflora intestinal en pacientes con sensibilidad trigo.
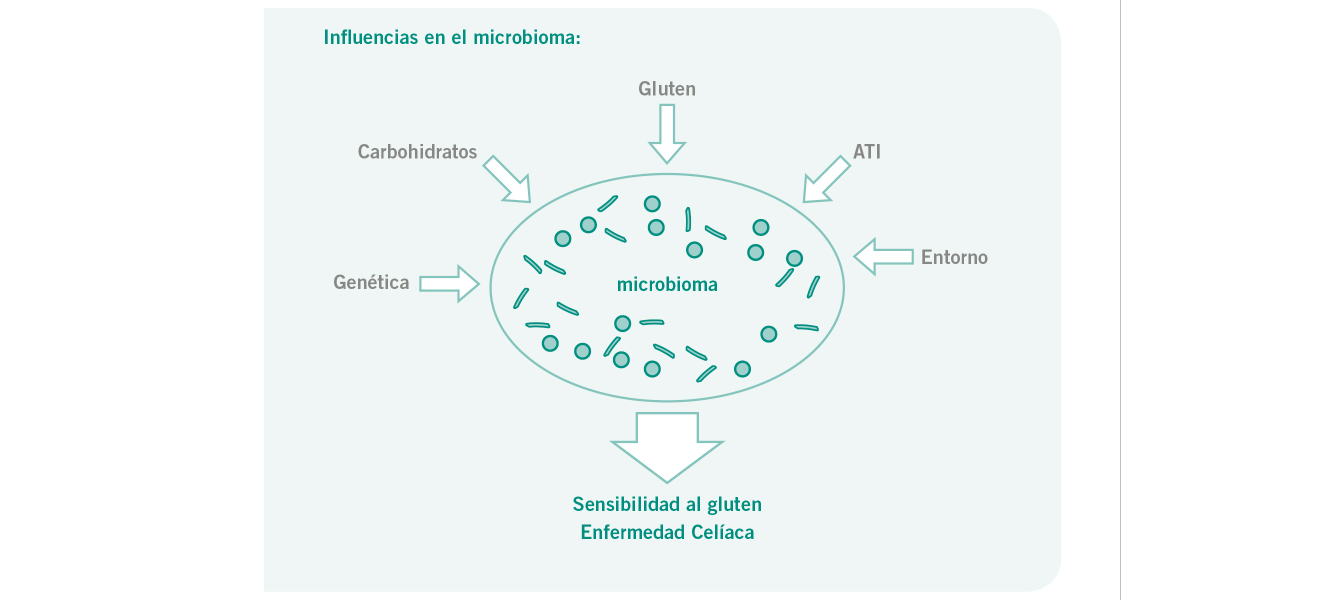
La creciente prevalencia de las intolerancias alimentarias, especialmente a determinados carbohidratos, representa un problema de salud a nivel global. [1] Asimismo, se ha observado como en la intolerancia al gluten o a sustancias asociadas al gluten, los inhibidores de la amilasa-tripsina (ATI) son responsables [2] de molestias intestinales (meteorismo, dolores, estreñimiento, diarrea) y extraintestinales (cansancio, dolor de cabeza, dolores en las articulaciones, irritaciones cutáneas). [3] La aparición de las intolerancias alimentarias se atribuye, entre otros aspectos, a las variaciones de la composición de la flora intestinal y su influencia en la tolerancia inmunológica de la membrana de la mucosa. [4]
La barrera intestinal es importante para mantener la homeostasis necesaria en el intestino. Si surge un desequilibrio intestinal puede debilitarse dicha barrera y dar lugar al síndrome del intestino poroso. Es importante evitar este tipo de desiquilibrios, ya que está comprobado que existe una asociación entre una barrera intestinal permeable y la aparición de enfermedades gastrointestinales e intolerancias alimentarias. [5]
El microbioma del tracto digestivo humano también ejerce un papel importante en la influencia de enfermedades asociadas al trigo y el gluten. [4]
Aunque la microflora del intestino depende de múltiples factores, la alimentación desempeña un papel importante. Por ejemplo, sabemos que la composición microbiana presente en el intestino delgado se determina principalmente a través de la competición de los microorganismos con el huésped para una captación y aprovechamiento rápidos de los carbohidratos, y el contrario, los microorganismos del colón se ven afectados por el complejo aprovechamiento de los carbohidratos y la competencia entre ellos. [6]
En este sentido, estudios con ratones han demostrado que seguir una dieta especial puede modificar rápidamente la composición microbiana intestinal. [7]
Numerosas publicaciones documentan la presencia de Streptococcus sp, E. coli, Clostridium sp, organismos ricos en G+C, Bacteroides uniformis, Blautia glucerasea y bifidobacterias en el intestino delgado y el intestino grueso. [8] Cada uno de estos microorganismos favorecen distintos sutratos, y en este sentido resulta interesante comentar que la B. uniformis aproveche principalmente la inulina, mientras que otras especies metabolizan principalmente los fructooligosacáridos o monosacáridos. [9]
Un indicio sobre la importancia de la composición microbiana en la enfermedad celíaca, viene por la presencia de una población bacteriana distinta en comparación con las personas sanas. Concretamente, en los pacientes celíacos se encontró un porcentaje considerablemente superior de Bifidobacterium bifidum y Lactobacillus sp., cuya diversidad disminuía considerablemente después de seguir una dieta sin gluten. [10] Asimismo, también pudo probarse in vitro que determinadas cepas de bifidobacterias debilitan una respuesta inmunitaria proinflamatoria producida por los péptidos de la gliadina y, por tanto, ejercen un efecto protector. [11,12]
Por otro lado, Wacklin et al. demostraron en 2013 una posible conexión entre la manifestación de la enfermedad celíaca en forma de síntomas gastrointestinales o extraintestinales y el microbioma. [13]
En otro estudio también realizado, se investigó el microbioma duodenal de pacientes celíacos con síntomas persistentes a pesar de haber seguido una dieta sin gluten (GFD) durante un largo periodo de tiempo, y se comparó con la de pacientes celíacos sin síntomas y con una mucosa del intestino delgado normalizada. Como resultado, se constataron diferencias en la colonización bacteriana del intestino delgado de los pacientes con síntomas persistentes en comparación con los pacientes sin síntomas. Por ejemplo, los pacientes con síntomas tenían una cantidad considerablemente mayor de proteobacterias, mientras que el número de bacteroidetes y firmicutes era inferior. En conjunto, los pacientes celíacos con síntomas persistentes presentaban una riqueza microbiana reducida. En algunos subgrupos de pacientes con enfermedad celíaca existen indicios de una disbiosis como posible causa de los síntomas recurrentes, lo que permitiría el empleo de nuevas posibles estrategias de tratamiento, como por ejemplo, en forma de probióticos o prebióticos. [14]
Asimismo, Smecuol et al. estudiaron el efecto del probiótico Natren Life Start Strain Super Strain a base de Bifidobacterium infantis en la manifestación clínica de pacientes celíacos no tratados. 12 de los 22 pacientes siguieron un tratamiento a base de dos cápsulas de B. infantis y los otros 10 un tratamiento a base de dos cápsulas con un placebo que tomaban durante las comidas. El empleo de probióticos no mostró ningún efecto en la permeabilidad intestinal, pero en el grupo tratado con B. infantis se verificó una mejora considerable de los síntomas de dispepsia, estreñimiento y reflujo. Además, en el grupo tratado con probióticos se verificó un incremento significativo de la proteína inflamatoria de macrófagos 1ß o MIP-1ß, por lo que este estudio apunta a un posible efecto atenuante de los probióticos en algunos síntomas de la enfermedad celíaca. No obstante, estos resultados deberían confirmarse con estudios adicionales. [15]
Un estudio reciente de Olivares et al. en pacientes con un alto riesgo genético de padecer enfermedad celíaca ha revelado la existencia de una composición microbiana modificada en bebés y niños de corta edad, es decir, ha descubierto un indicio de que posiblemente la variación del microbioma tiene lugar en un estadio muy temprano. En comparación con los bebés sin un alto riesgo de padecer enfermedad celíaca, en los portadores con el mercador HLA DQ2 positivo se ha podido verificar una cantidad considerablemente superior de firmicutes y proteobacterias, así como una cantidad reducida de actinobacterias. Además, la cantidad de especies de bifidobacterias era muy reducida. Por tanto, una predisposición genética del marcador HLA DQ2 parece influir en el microbioma y también en la forma de la aparición de la enfermedad, una conclusión que podría ser de gran ayuda a la hora de determinar el riesgo de padecer enfermedad celíaca. [16]
En general, estos datos muestran que existe una conexión entre la aparición y la sintomatología de las enfermedades relacionadas con el gluten y el microbioma humano. No obstante, todavía no se ha determinado en qué medida determinadas especies de bacterias están implicadas en la patogénesis de la enfermedad celíaca o incluso en la sensibilidad al gluten (SGNC), o bien si a través de la mucosa dañada obtienen condiciones de vida privilegiadas. Estos son aspectos que deben estudiarse en mayor profundidad.
A partir de los primeros datos de Biesiekierski et al. (2013) se puede especular que los carbohidratos fermentables también provocan la sintomatología en los pacientes con sensibilidad al gluten, o que como mínimo tienen alguna influencia. Por consiguiente, consideramos muy interesante una determinación de la colonización microbiana para comprender las posibles diferencias entre estos pacientes y los grupos de control sanos.
Por ello, en el marco de un estudio prospectivo controlado estudiamos las variaciones de la microflora intestinal en pacientes con sensibilidad al gluten demostrada sometidos a una alimentación variada, una alimentación sin gluten y una alimentación pobre en FODMAP, para determinar la influencia de las cadenas de carbohidratos en el crecimiento bacteriano y su diferenciación. La comparación con un grupo de control sano y una población de control con enfermedad celíaca demostrada, contribuyen a una mejor diferenciación de las cepas bacterianas responsables de la aparición de la sensibilidad al gluten.
La demostración de una composición de la flora intestinal específica en pacientes con sensibilidad al gluten podría representar un enfoque innovador para una terapia probiótica específica y sin efectos secundarios.
La barrera intestinal es importante para mantener la homeostasis necesaria en el intestino. Si surge un desequilibrio intestinal puede debilitarse dicha barrera y dar lugar al síndrome del intestino poroso. Es importante evitar este tipo de desiquilibrios, ya que está comprobado que existe una asociación entre una barrera intestinal permeable y la aparición de enfermedades gastrointestinales e intolerancias alimentarias. [5]
El microbioma del tracto digestivo humano también ejerce un papel importante en la influencia de enfermedades asociadas al trigo y el gluten. [4]
Aunque la microflora del intestino depende de múltiples factores, la alimentación desempeña un papel importante. Por ejemplo, sabemos que la composición microbiana presente en el intestino delgado se determina principalmente a través de la competición de los microorganismos con el huésped para una captación y aprovechamiento rápidos de los carbohidratos, y el contrario, los microorganismos del colón se ven afectados por el complejo aprovechamiento de los carbohidratos y la competencia entre ellos. [6]
En este sentido, estudios con ratones han demostrado que seguir una dieta especial puede modificar rápidamente la composición microbiana intestinal. [7]
Numerosas publicaciones documentan la presencia de Streptococcus sp, E. coli, Clostridium sp, organismos ricos en G+C, Bacteroides uniformis, Blautia glucerasea y bifidobacterias en el intestino delgado y el intestino grueso. [8] Cada uno de estos microorganismos favorecen distintos sutratos, y en este sentido resulta interesante comentar que la B. uniformis aproveche principalmente la inulina, mientras que otras especies metabolizan principalmente los fructooligosacáridos o monosacáridos. [9]
Un indicio sobre la importancia de la composición microbiana en la enfermedad celíaca, viene por la presencia de una población bacteriana distinta en comparación con las personas sanas. Concretamente, en los pacientes celíacos se encontró un porcentaje considerablemente superior de Bifidobacterium bifidum y Lactobacillus sp., cuya diversidad disminuía considerablemente después de seguir una dieta sin gluten. [10] Asimismo, también pudo probarse in vitro que determinadas cepas de bifidobacterias debilitan una respuesta inmunitaria proinflamatoria producida por los péptidos de la gliadina y, por tanto, ejercen un efecto protector. [11,12]
Por otro lado, Wacklin et al. demostraron en 2013 una posible conexión entre la manifestación de la enfermedad celíaca en forma de síntomas gastrointestinales o extraintestinales y el microbioma. [13]
En otro estudio también realizado, se investigó el microbioma duodenal de pacientes celíacos con síntomas persistentes a pesar de haber seguido una dieta sin gluten (GFD) durante un largo periodo de tiempo, y se comparó con la de pacientes celíacos sin síntomas y con una mucosa del intestino delgado normalizada. Como resultado, se constataron diferencias en la colonización bacteriana del intestino delgado de los pacientes con síntomas persistentes en comparación con los pacientes sin síntomas. Por ejemplo, los pacientes con síntomas tenían una cantidad considerablemente mayor de proteobacterias, mientras que el número de bacteroidetes y firmicutes era inferior. En conjunto, los pacientes celíacos con síntomas persistentes presentaban una riqueza microbiana reducida. En algunos subgrupos de pacientes con enfermedad celíaca existen indicios de una disbiosis como posible causa de los síntomas recurrentes, lo que permitiría el empleo de nuevas posibles estrategias de tratamiento, como por ejemplo, en forma de probióticos o prebióticos. [14]
Asimismo, Smecuol et al. estudiaron el efecto del probiótico Natren Life Start Strain Super Strain a base de Bifidobacterium infantis en la manifestación clínica de pacientes celíacos no tratados. 12 de los 22 pacientes siguieron un tratamiento a base de dos cápsulas de B. infantis y los otros 10 un tratamiento a base de dos cápsulas con un placebo que tomaban durante las comidas. El empleo de probióticos no mostró ningún efecto en la permeabilidad intestinal, pero en el grupo tratado con B. infantis se verificó una mejora considerable de los síntomas de dispepsia, estreñimiento y reflujo. Además, en el grupo tratado con probióticos se verificó un incremento significativo de la proteína inflamatoria de macrófagos 1ß o MIP-1ß, por lo que este estudio apunta a un posible efecto atenuante de los probióticos en algunos síntomas de la enfermedad celíaca. No obstante, estos resultados deberían confirmarse con estudios adicionales. [15]
Un estudio reciente de Olivares et al. en pacientes con un alto riesgo genético de padecer enfermedad celíaca ha revelado la existencia de una composición microbiana modificada en bebés y niños de corta edad, es decir, ha descubierto un indicio de que posiblemente la variación del microbioma tiene lugar en un estadio muy temprano. En comparación con los bebés sin un alto riesgo de padecer enfermedad celíaca, en los portadores con el mercador HLA DQ2 positivo se ha podido verificar una cantidad considerablemente superior de firmicutes y proteobacterias, así como una cantidad reducida de actinobacterias. Además, la cantidad de especies de bifidobacterias era muy reducida. Por tanto, una predisposición genética del marcador HLA DQ2 parece influir en el microbioma y también en la forma de la aparición de la enfermedad, una conclusión que podría ser de gran ayuda a la hora de determinar el riesgo de padecer enfermedad celíaca. [16]
En general, estos datos muestran que existe una conexión entre la aparición y la sintomatología de las enfermedades relacionadas con el gluten y el microbioma humano. No obstante, todavía no se ha determinado en qué medida determinadas especies de bacterias están implicadas en la patogénesis de la enfermedad celíaca o incluso en la sensibilidad al gluten (SGNC), o bien si a través de la mucosa dañada obtienen condiciones de vida privilegiadas. Estos son aspectos que deben estudiarse en mayor profundidad.
A partir de los primeros datos de Biesiekierski et al. (2013) se puede especular que los carbohidratos fermentables también provocan la sintomatología en los pacientes con sensibilidad al gluten, o que como mínimo tienen alguna influencia. Por consiguiente, consideramos muy interesante una determinación de la colonización microbiana para comprender las posibles diferencias entre estos pacientes y los grupos de control sanos.
Por ello, en el marco de un estudio prospectivo controlado estudiamos las variaciones de la microflora intestinal en pacientes con sensibilidad al gluten demostrada sometidos a una alimentación variada, una alimentación sin gluten y una alimentación pobre en FODMAP, para determinar la influencia de las cadenas de carbohidratos en el crecimiento bacteriano y su diferenciación. La comparación con un grupo de control sano y una población de control con enfermedad celíaca demostrada, contribuyen a una mejor diferenciación de las cepas bacterianas responsables de la aparición de la sensibilidad al gluten.
La demostración de una composición de la flora intestinal específica en pacientes con sensibilidad al gluten podría representar un enfoque innovador para una terapia probiótica específica y sin efectos secundarios.
Autor
PROF. DR. MED. YURDAGÜL ZOPF
Jefe de Clínica y Departamento de Medicina Nutricional Experimental, Especialista en Medicina Interna, Clínica Médica 1, Erlangen
PRIV. DOZ. DR. RER. NAT. WALBURGA DIETERICH
Investigador Asociado del Departamento de Medicina Interna 1, Campus Kussmaul para la Investigación Médica, Erlangen
Jefe de Clínica y Departamento de Medicina Nutricional Experimental, Especialista en Medicina Interna, Clínica Médica 1, Erlangen
PRIV. DOZ. DR. RER. NAT. WALBURGA DIETERICH
Investigador Asociado del Departamento de Medicina Interna 1, Campus Kussmaul para la Investigación Médica, Erlangen
Referencias
- Zopf Y. et al., The differential diagnosis of food intolerance. Dtsch Arztebl Int. 2009 May;106(21):359-69;
- Junker Y. et al., Wheat amylase trypsin inhibitors drive intestinal inflammation via activation of toll-like receptor 4. J Exp Med. 2012 Dec 17;209(13):2395-408.
- Volta U. et al., Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness. Cell Mol Immunol. 2013 Sep;10(5):38392.
- Galipeau HJ, Verdu EF. Gut microbes and adverse food reactions: Focus on gluten related disorders. Gut Microbes. 2014;5(5):594-605.
- Barbara G. et al., Mucosal permeability and immune activation as potential therapeutic targets of probiotics in irritable bowel syndrome. J Clin Gastroenterol. 2012 Oct;46 Suppl:S52-5.
- Zoetendal, E.G. and W.M. de Vos, Effect of diet on the intestinal microbiota and its activity. Curr Opin Gastroenterol, 2014.
- Ooi, J.H., et al., Dominant effects of the diet on the microbiome and the local and systemic immune response in mice. PLoS One, 2014. 9(1): p. e86366.
- Zoetendal, E.G., et al., The human small intestinal microbiota is driven by rapid uptake and conversion of simple carbohydrates. ISME J, 2012. 6(7): p. 1415-26.
- Tannock, G.W., et al., RNA-stable isotope probing (RNA-SIP) shows carbon utilization from inulin by specific bacterial populations in the large bowel of rats. Appl Environ Microbiol, 2014.
- Nistal, E., et al., Differences in faecal bacteria populations and faecal bacteria metabolism in healthy adults and celiac disease patients. Biochimie, 2012. 94(8): p. 1724-9.
- Medina, M., et al., Bifidobacterium strains suppress in vitro the pro-inflammatory milieu triggered by the large intestinal microbiota of coeliac patients. J Inflamm (Lond), 2008. 5: p. 19.
- Laparra, J.M. and Y. Sanz, Bifidobacteria inhibit the inflammatory response induced by gliadins in intestinal epithelial cells via modifications of toxic peptide generation during digestion. J Cell Biochem, 2010. 109(4): p. 801-7.
- Wacklin, P., et al., The duodenal microbiota composition of adult celiac disease patients is associated with the clinical manifestation of the disease. Inflamm Bowel Dis, 2013. 19(5): p. 934-41.
- Wacklin, P., et al., Altered duodenal microbiota composition in celiac disease patients suffering from persistent symptoms on a long-term gluten-free diet. Am J Gastroenterol, 2014. 109(12): p. 1933-41.
- Smecuol E, H.H., Sugai E, Corso L, Cherñavsky AC, Bellavite FP, González A, Vodánovich F, Moreno ML, Vázquez H, Lozano G, Niveloni S, Mazure R, Meddings J, Mauriño E, Bai JC., Exploratory, randomized, double-blind, placebo-controlled study on the effects of Bifidobacterium infantis natren life start strain super strain in active celiac disease. J Clin Gastroenterol, 2013. 47: p. 139147.
- Olivares, M., et al., The HLA-DQ2 genotype selects for early intestinal microbiota composition in infants at high risk of developing coeliac disease. Gut, 2015. 64(3): p. 406-17.
www.drschaer-institute.com
