Diagnose der Zöliakie
Die Diagnose der Zöliakie stützt sich auf vier Säulen. Wichtig ist, dass sich der Patient vor der Diagnose normal, sprich glutenhaltig ernährt.
Bis zur sicheren Zöliakiediagnose sind vier Schritte zu durchlaufen. Angefangen bei der Anamnese bei Vorhandensein entsprechender Beschwerden, werden im weiteren Verlauf serologische und histologische Untersuchungen durchgeführt. Zum Abschluss sichert eine Testphase unter glutenfreier Ernährung die Diagnose.
I. Anamnese
Die Anamnese umfasst sowohl eine klassische Familienanamnese als auch eine Ernährungsanamnese, die gezielt auf glutenhaltige Lebensmittel ausgerichtet ist. Weiterhin wird in diesem Schritt das klinische Beschwerdebild abgefragt. Erfasst werden hierbei Symptome wie Durchfall, Gewichts- und Kraftverlust, aufgeblähter Bauch, Bauchschmerzen, Übelkeit und Wachstumsstörungen bei Kindern.
II. Serologie
Der Goldstandard bei der serologischen Untersuchung ist die Bestimmung der Anti-Transglutaminase-Antikörper IgA (tTg-IgA). Fällt dieser Befund negativ aus, werden zusätzlich die Anti-Transglutaminase-Antikörper IgG (tTg-IgG) bestimmt. Des Weiteren können die Anti-Endomysium-Antikörper IgA (EMA) serologisch bestimmt werden. Routinemäßig sollte auch immer das Gesamt-IgA bestimmt werden, da ein Immunglobulin-A-Mangel bei Zöliakiepatienten gehäuft (3 bis 11 Prozent) vorkommt. Liegt ein IgA-Mangel vor, ist die serologische Diagnostik der Immunglobulin-A-Antikörper nicht verwertbar.
Die folgenden Tests sind laut der S2k-Leitlinie nicht zur Diagnostik geeignet
- Antikörper gegen negatives Gliadin
- Speichel- und Stuhltests
- Blutschnelltests
III. Histologie
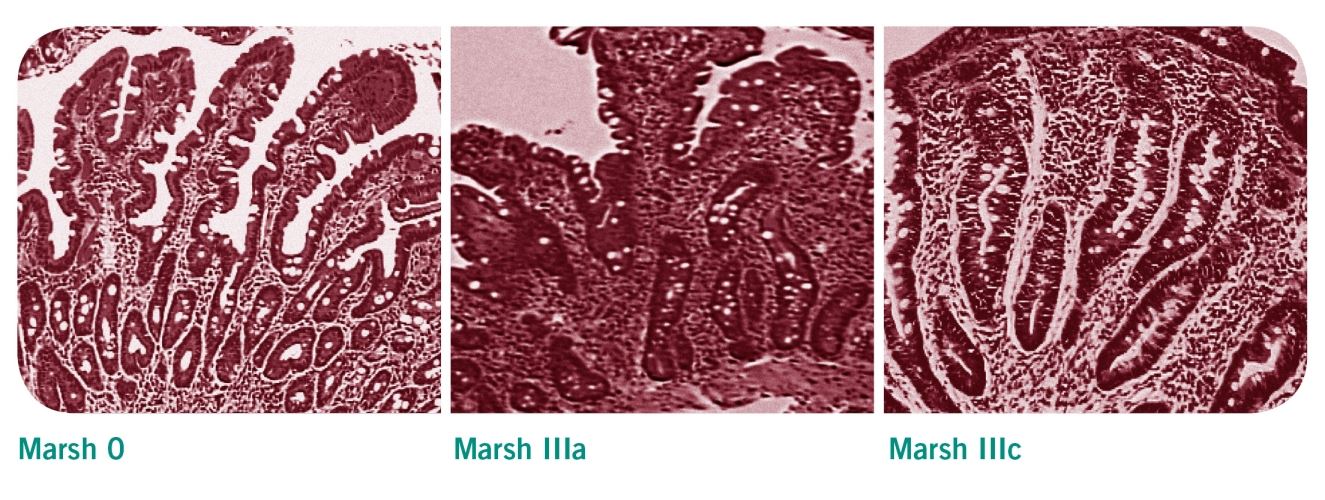
Die histologische Untersuchung umfasst eine initiale Ösophagogastroduodenoskopie mit Abnahme von Duodenalbiopsien. Dabei werden mindestens drei Proben aus dem absteigenden Teil des Duodenums genommen plus eine aus dem Übergang zum Jejunum. Klassifiziert werden die histologischen Veränderungen in diesen Proben nach Marsh. Typisch für Zöliakie sind zum einen eine erhöhte Anzahl der intraepithelialen Lymphozyten (IEL) sowie eine Hypertrophie/Hyperplasie und Verlängerung der Krypten. Die Dünndarmzotten bei Zöliakiepatienten sind verkürzt, reduziert oder fehlen komplett. Dies entspricht der Klassifizierung Marsh IIIa bis IIIc.
Die Marsh-Klassifikation
- Marsh 0: Gesunde Dünndarmschleimhaut und Darmzotten
- Marsh I: Vermehrte Intraepitheliale Lymphozyten (IEL) >30/100 Epithelzellen
- Marsh II: Vermehrte IEL und Kryptenhyperplasie
- Marsh IIIa bis IIIc: Vermehrte IEL und Kryptenhyperplasie, Dünndarmschleimhaut mit teilweise bis vollständig zurückgebildeten Darmzotten
Biopsie bei Kindern?
Eine Dünndarmbiopsie ist für eine sichere Zöliakiediagnose immer erforderlich. Eine Ausnahme gilt entsprechend der ESPGHAN-Leitlinien nur für Kinder mit typischen klinischen Symptomen und Zeichen einer Malabsorption. Zudem müssen weitere bestimmte Faktoren vorliegen, beispielsweise erhöhte Transglutaminase-Antikörper über das Zehnfache des Normbereichs, bei denen in Absprache mit dem Kindergastroenterologen auf eine Biopsie verzichtet werden könnte.
IV. Testphase unter glutenfreier Ernährung
Nach der serologischen und histologischen Untersuchung folgt der strikte Ausschluss glutenhaltiger Lebensmittel aus dem Speiseplan. Die Zöliakiediagnose gilt als bestätigt, wenn sich die Symptome bessern und wenn sich bei einer erneuten Serologie zeigt, dass die Antikörper auf die glutenfreie Ernährung ansprechen. Gerade für Neudiagnostizierte ist bei der Umstellung der Essgewohnheiten die Unterstützung durch eine kompetente Ernährungsberatung von zentraler Bedeutung.
Regelmäßige Folgeuntersuchungen
Zöliakiebetroffenen wird empfohlen, jährlich zur ärztlichen Kontrolluntersuchung zu gehen, um Mangelerscheinungen und Komplikationen der Zöliakie auszuschließen. Dabei sollten einmal im Jahr die Gewebstransglutaminase-IgA bestimmt werden, um die Einhaltung der glutenfreien Ernährung zu kontrollieren. Negative Antikörper weisen auf eine gute Compliance des Patienten hin. Eine erneute Dünndarmbiopsie zur Verlaufskontrolle wird bei gutem Ansprechen auf die glutenfreie Ernährung nur in Ausnahmefälle empfohlen.
Verlaufskontrollen werden empfohlen:
Verlaufskontrollen werden empfohlen:
- drei Monate nach der Diagnosestellung
- ein Jahr nach Diagnosestellung
- jährlich ein Leben lang
Weiterführende Informationen
Download
6
Alle anzeigen
E-Learning
1
Alle anzeigen
Präsentationen
4
Alle anzeigen
Studien
6
Alle anzeigen

3-Stufen-Beratung III: Hinweise für den Berater
Ergänzend zu den Unterlagen, die durch das Beratungsgespräch führen, können sie hier kleine Notizzettel im DIN-A6-Format, mit weiterführenden Informationen und didaktischen Hinweisen herunterladen.

3-Stufen-Beratung I: Schulungsunterlagen Zöliakie
Hier können Sie alle Schulungsunterlagen zum Thema Zöliakie und glutenfreie Ernährung herunterladen. Laden Sie zusätzlich den "Hinweis für Berater" mit weiterführenden Informationen und didaktischen Hinweisen herunter.

Diagnoseschema für Zöliakie
Dr. med. Michael Schumann, Klinik für Gastroenterologie, Rheumatologie und Infektiologie an der Berliner Charité, hat den Diagnoseprozess zusammengefasst und erläutert, warum Zöliakie häufig unentdeckt bleibt und wie die Diagnoserate gesteigert werden kann.

Infoblatt zur Abrechnung der Zöliakie
Rund um das Thema Abrechnung nach EBM und GOÄ bei Glutenunverträglichkeiten hat Dr. med., Dr. rer. nat. Peter Schlüter im Namen von Dr. Schär ein übersichtliches Infoblatt erarbeitet. Neben den GO-Nr. und den Punkten enthält es auch einen Algorithmus zur Differenzierung von glutenbedingten Funktionsstörungen.

Merzettel - Anamnese in 3 Schritten
Dieser Merkzettel hält die wichtigsten Anamnesefragen und diagnostischen Vorgehensweisen direkt im Arzt-Patientengespräch auf einen Blick bereit, z. B. gut sichtbar unter der Schreibtischunterlage bzw. an der Pinnwand angebracht oder in der Kitteltasche verstaut.

Fragebogen Wartezimmer
Patienten, die mit unspezifischen Magen-Darm-Beschwerden in die Praxis kommen, können die Zeit im Wartezimmer ab sofort sinnvoll nutzen. Der Fragebogen enthält alle wichtigen Kriterien, die dem Arzt die Diagnostik erleichtern. Abgefragt werden beispielsweise die genaue Art und Dauer der Beschwerden, der Verlauf, mögliche Vorerkrankungen, genetische Hintergründe oder Hinweise auf Begleiterkrankungen. Der Arzt kann den ausgefüllten Bogen während des Anamnesegesprächs als Hilfestellung nutzen, weiterführende Tests damit anordnen und ihn in der Patientendatei ablegen.

3-Stufen-Beratung III: Hinweise für den Berater
Ergänzend zu den Unterlagen, die durch das Beratungsgespräch führen, k...

3-Stufen-Beratung I: Schulungsunterlagen Zöliakie
Hier können Sie alle Schulungsunterlagen zum Thema Zöliakie und gluten...

Diagnoseschema für Zöliakie
Dr. med. Michael Schumann, Klinik für Gastroenterologie, Rheumatologie...

Infoblatt zur Abrechnung der Zöliakie
Rund um das Thema Abrechnung nach EBM und GOÄ bei Glutenunverträglichk...

Merzettel - Anamnese in 3 Schritten
Dieser Merkzettel hält die wichtigsten Anamnesefragen und diagnostisch...

Fragebogen Wartezimmer
Patienten, die mit unspezifischen Magen-Darm-Beschwerden in die Praxis...

Modul 2 - Grundlagen der Zöliakie Teil 2
Aufgrund der häufig vielfältigen Beschwerden und verschiedenen Formen der Zöliakie ist diese oft schwierig zu diagnostizieren. Zunächst werden die einzelnen Schritte einer Zöliakiediagnose erläutert, bestehend aus Anamnese, Serologie und Histologie. Weiterhin werden assoziierte Erkrankungen aufgezählt und deren Verbindung mit Zöliakie erklärt. Im letzten Teil des Moduls wird auf Komplikationen hingewiesen, die in Zusammenhang mit Zöliakie auftreten und wie mit diesen umgegangen werden kann.
Die Lerninhalte wurden gemeinsam mit Prof. Dr. med. Wolfgang Holtmeier zusammengestellt.
Die Lerninhalte wurden gemeinsam mit Prof. Dr. med. Wolfgang Holtmeier zusammengestellt.

Modul 2 - Grundlagen der Zöliakie Teil 2
Aufgrund der häufig vielfältigen Beschwerden und verschiedenen Formen ...

Glutenunverträglichkeiten erkennen und richtig diagnostizieren (2015)
Dr. med. Michael Schumann
Charité - Universitätsmedizin Berlin
Fortbildungsreihe Medical Tribune 2015
Charité - Universitätsmedizin Berlin
Fortbildungsreihe Medical Tribune 2015

Glutenunverträglichkeiten: von Zöliakie bis Glutensensitivität (2015)
Dr. med. Peter Strauven
Privatarztpraxis Bonn
Fortbildungsreihe Medical Tribune 2015
Privatarztpraxis Bonn
Fortbildungsreihe Medical Tribune 2015

Zöliakie bis Glutensensitivität erkennen und richtig diagnostizieren (2014)
Walter Burghardt
Universitätsklinikum Würzburg
Universitätsklinikum Würzburg

Glutenunverträglichkeiten erkennen, behandeln und abrechnen (2014)
Dr. Dr. Peter Schlüter
Praxis für Allgemeinmedizin Hemsbach
Praxis für Allgemeinmedizin Hemsbach

Glutenunverträglichkeiten erkennen und richtig diagnostizieren (2015)
Dr. med. Michael Schumann
Charité - Universitätsmedizin Berlin
For...

Glutenunverträglichkeiten: von Zöliakie bis Glutensensitivität (2015)
Dr. med. Peter Strauven
Privatarztpraxis Bonn
Fortbildungsreihe Me...

Zöliakie bis Glutensensitivität erkennen und richtig diagnostizieren (2014)
Walter Burghardt
Universitätsklinikum Würzburg...

Glutenunverträglichkeiten erkennen, behandeln und abrechnen (2014)
Dr. Dr. Peter Schlüter
Praxis für Allgemeinmedizin Hemsbach...

A Retrospective Application of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosis of Coeliac Disease in New Zealand Children.
In 2012 the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN) published an updated guideline for the diagnosis of Coeliac disease, proposing a non-biopsy based diagnostic approach for a proportion of symptomatic children where appropriate serology (tTG IgA level at least 10 times upper limit of normal and positive EMA) and 'at risk' genotype (HLA DQ2 or DQ8) was evident. This retrospective study aimed to assess the applicability of this guideline to children in New Zealand. Children less than 16 years of age investigated for coeliac disease with small bowel biopsy in between January 2010 and December 2012 were identified. The results of those with tissue transglutaminase IgA (tTG) levels greater than 50 units (10 times upper limit of normal), positive endomysial antibodies and HLA DQ2/DQ8 were used to calculate sensitivity and specificity. Data from 160 children was available: 70 had biopsy-confirmed Coeliac disease, and 90 had negative biopsies. Limited data relating to HLA DQ2/DQ8 testing precluded application of the guidelines to all patients. However, the isolated use of the anti-tTG antibody cut off of 10 times the upper limit of normal generated a sensitivity of 67% and moderately high specificity of 92%. Specificity increased to 97% when limited EMA and HLA DQ2/DQ8 data was added. data, levels above 50 units and a specificity of 92%. Specificity increased to 97% when limited EMA and HLA DQ2/DQ8 data was added. A potential 67% reduction in the number of diagnostic biopsies performed would significantly reduce the work load and cost to the health system along with inconvenience and stress to families. However, it is important to avoid incorrect diagnosis of coeliac disease - if this current study is representative of the local population, up to three children out of every hundred investigated for coeliac disease could be falsely diagnosed. The limited amount of data was a major limitation of this study, therefore the value of the 2012 ESPGHAN guideline for the diagnosis of coeliac disease should now be evaluated prospectively.
Resource: International Journal of Coeliac Disease, Dec 2014 (vol 2; no. 4)
Resource: International Journal of Coeliac Disease, Dec 2014 (vol 2; no. 4)

Coeliac disease: The debate on coeliac disease screening - are we there yet?
The majority of patients with coeliac disease are undiagnosed, leading to debate about the utility of screening. The heterogeneous clinical presentation, which includes asymptomatic forms, can partially explain the difficulties faced when identifying coeliac disease. Now, Kurppa and colleagues add another element to the debate by strengthening the arguments for general screening.
Resource: Nature Reviews Gastroenterology & Hepatology Volume: 11, Pages: 457–458 201
Resource: Nature Reviews Gastroenterology & Hepatology Volume: 11, Pages: 457–458 201

Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology
ABSTRACT
A multidisciplinary panel of 18 physicians and 3 non-physicians from eight countries (Sweden, UK, Argentina, Australia, Italy, Finland, Norway and the USA) reviewed the literature on diagnosis and management of adult coeliac disease (CD).
This paper presents the recommendations of the British Society of Gastroenterology. Areas of controversies were explored through phone meetings and web surveys. Nine working groups examined the following areas of CD diagnosis and management: classification of CD; genetics and immunology; diagnostics; serology and endoscopy; follow-up; gluten-free diet; refractory CD and malignancies; quality of life; novel treatments; patient support; and screening for CD.
Resource: Gut doi:10.1136/gutjnl-2013-306578
Jonas F Ludvigsson, Julio C Bai, Federico Biagi, Timothy R Card, Carolina Ciacci, Paul J Ciclitira, Peter H R Green, Marios Hadjivassiliou, Anne Holdoway, David A van Heel, Katri Kaukinen, Daniel A Leffler, Jonathan N Leonard, Knut E A Lundin, Norma McGough, Mike Davidson, Joseph A Murray, Gillian L Swift, Marjorie M Walker, Fabiana Zingone, David S Sanders, Authors of the BSG Coeliac Disease Guidelines Development Group
A multidisciplinary panel of 18 physicians and 3 non-physicians from eight countries (Sweden, UK, Argentina, Australia, Italy, Finland, Norway and the USA) reviewed the literature on diagnosis and management of adult coeliac disease (CD).
This paper presents the recommendations of the British Society of Gastroenterology. Areas of controversies were explored through phone meetings and web surveys. Nine working groups examined the following areas of CD diagnosis and management: classification of CD; genetics and immunology; diagnostics; serology and endoscopy; follow-up; gluten-free diet; refractory CD and malignancies; quality of life; novel treatments; patient support; and screening for CD.
Resource: Gut doi:10.1136/gutjnl-2013-306578
Jonas F Ludvigsson, Julio C Bai, Federico Biagi, Timothy R Card, Carolina Ciacci, Paul J Ciclitira, Peter H R Green, Marios Hadjivassiliou, Anne Holdoway, David A van Heel, Katri Kaukinen, Daniel A Leffler, Jonathan N Leonard, Knut E A Lundin, Norma McGough, Mike Davidson, Joseph A Murray, Gillian L Swift, Marjorie M Walker, Fabiana Zingone, David S Sanders, Authors of the BSG Coeliac Disease Guidelines Development Group

Serological Assessment for Celiac Disease in IgA Deficient Adults
Abstract
Purpose: Selective immunoglobulin A deficiency is the most common primary immunodeficiency disorder that is strongly overrepresented among patients with celiac disease (CD). IgG antibodies against tissue transglutaminase (tTG) and deamidated gliadin peptides (DGP) serve as serological markers for CD in IgA deficient individuals, although the diagnostic value remains uncertain. The aim of this study was to investigate the prevalence of these markers in a large cohort of IgA deficient adults with confirmed or suspected CD and relate the findings to gluten free diet.
Methods: Sera from 488,156 individuals were screened for CD in seven Swedish clinical immunology laboratories between 1998 and 2012. In total, 356 out of 1,414 identified IgA deficient adults agreed to participate in this study and were resampled. Forty-seven IgA deficient blood donors served as controls. Analyses of IgG antibodies against tTG and DGP as well as HLA typing were performed and a questionnaire was used to investigate adherence to gluten free diet. Available biopsy results were collected.
Results: Out of the 356 IgA deficient resampled adults, 67 (18.8%) were positive for IgG anti-tTG and 79 (22.2%) for IgG anti-DGP, 54 had biopsy confirmed CD. Among the 47 IgA deficient blood donors, 4 (9%) were positive for IgG anti-tTG and 8 (17%) for anti-DGP. Four were diagnosed with biopsy verified CD, however, 2 of the patients were negative for all markers. Sixty-eight of 69 individuals with positive IgG anti-tTG were HLA-DQ2/DQ8 positive whereas 7 (18.9%) of the 37 individuals positive for IgG anti-DGP alone were not.
Conclusions: IgG anti-tTG seems to be a more reliable marker for CD in IgA deficient adults whereas the diagnostic specificity of anti-DGP appears to be lower. High levels of IgG antibodies against tTG and DGP were frequently found in IgA deficient adults despite adhering to gluten free diet.
Resource: PLOS ONE, 9 April 2014, Vol 9, Issue 4 (www.plosone.org)
Purpose: Selective immunoglobulin A deficiency is the most common primary immunodeficiency disorder that is strongly overrepresented among patients with celiac disease (CD). IgG antibodies against tissue transglutaminase (tTG) and deamidated gliadin peptides (DGP) serve as serological markers for CD in IgA deficient individuals, although the diagnostic value remains uncertain. The aim of this study was to investigate the prevalence of these markers in a large cohort of IgA deficient adults with confirmed or suspected CD and relate the findings to gluten free diet.
Methods: Sera from 488,156 individuals were screened for CD in seven Swedish clinical immunology laboratories between 1998 and 2012. In total, 356 out of 1,414 identified IgA deficient adults agreed to participate in this study and were resampled. Forty-seven IgA deficient blood donors served as controls. Analyses of IgG antibodies against tTG and DGP as well as HLA typing were performed and a questionnaire was used to investigate adherence to gluten free diet. Available biopsy results were collected.
Results: Out of the 356 IgA deficient resampled adults, 67 (18.8%) were positive for IgG anti-tTG and 79 (22.2%) for IgG anti-DGP, 54 had biopsy confirmed CD. Among the 47 IgA deficient blood donors, 4 (9%) were positive for IgG anti-tTG and 8 (17%) for anti-DGP. Four were diagnosed with biopsy verified CD, however, 2 of the patients were negative for all markers. Sixty-eight of 69 individuals with positive IgG anti-tTG were HLA-DQ2/DQ8 positive whereas 7 (18.9%) of the 37 individuals positive for IgG anti-DGP alone were not.
Conclusions: IgG anti-tTG seems to be a more reliable marker for CD in IgA deficient adults whereas the diagnostic specificity of anti-DGP appears to be lower. High levels of IgG antibodies against tTG and DGP were frequently found in IgA deficient adults despite adhering to gluten free diet.
Resource: PLOS ONE, 9 April 2014, Vol 9, Issue 4 (www.plosone.org)

Coeliac Patients Are Undiagnosed at Routine Upper Endoscopy
Abstract
Background and Aims
Two out of three patients with Coeliac Disease (CD) in Australia are undiagnosed. This prospective clinical audit aimed to determine how many CD patients would be undiagnosed if duodenal biopsy had only been performed if the mucosa looked abnormal or the patient presented with typical CD symptoms.
Methods
All eligible patients presenting for upper gastrointestinal endoscopy (OGD) in a regional center from 2004–2009 underwent prospective analysis of presenting symptoms and duodenal biopsy. Clinical presentations were defined as either Major (diarrhea, weight loss, iron deficiency, CD family history or positive celiac antibodies- Ab) or Minor Clinical Indicators (CI) to duodenal biopsy (atypical symptoms). Newly diagnosed CD patients had follow up celiac antibody testing.
Results
Thirty-five (1.4%) new cases of CD were identified in the 2,559 patients biopsied at upper endoscopy. Almost a quarter (23%) of cases presented with atypical symptoms. There was an inverse relationship between presentation with Major CI’s and increasing age (<16, 16–59 and >60: 100%, 81% and 50% respectively, p = 0.03); 28% of newly diagnosed CD patients were aged over 60 years. Endoscopic appearance was a useful diagnostic tool in only 51% (18/35) of CD patients. Coeliac antibodies were positive in 34/35 CD patients (sensitivity 97%).
Conclusions
Almost one quarter of new cases of CD presented with atypical symptoms and half of the new cases had unremarkable duodenal mucosa. At least 10% of new cases of celiac disease are likely to be undiagnosed at routine upper endoscopy, particularly patients over 60 years who more commonly present atypically. All new CD patients could be identified in this study by performing pre-operative celiac antibody testing on all patients presenting for OGD and proceeding to biopsy only positive antibody patients and those presenting with either Major CI or abnormal duodenal mucosa for an estimated cost of AUS$4,629 and AUS$3,710 respectively.
Resource: PLOS ONE, March 2014, Vol 9, Issue 3 (www.plosone.org)
Background and Aims
Two out of three patients with Coeliac Disease (CD) in Australia are undiagnosed. This prospective clinical audit aimed to determine how many CD patients would be undiagnosed if duodenal biopsy had only been performed if the mucosa looked abnormal or the patient presented with typical CD symptoms.
Methods
All eligible patients presenting for upper gastrointestinal endoscopy (OGD) in a regional center from 2004–2009 underwent prospective analysis of presenting symptoms and duodenal biopsy. Clinical presentations were defined as either Major (diarrhea, weight loss, iron deficiency, CD family history or positive celiac antibodies- Ab) or Minor Clinical Indicators (CI) to duodenal biopsy (atypical symptoms). Newly diagnosed CD patients had follow up celiac antibody testing.
Results
Thirty-five (1.4%) new cases of CD were identified in the 2,559 patients biopsied at upper endoscopy. Almost a quarter (23%) of cases presented with atypical symptoms. There was an inverse relationship between presentation with Major CI’s and increasing age (<16, 16–59 and >60: 100%, 81% and 50% respectively, p = 0.03); 28% of newly diagnosed CD patients were aged over 60 years. Endoscopic appearance was a useful diagnostic tool in only 51% (18/35) of CD patients. Coeliac antibodies were positive in 34/35 CD patients (sensitivity 97%).
Conclusions
Almost one quarter of new cases of CD presented with atypical symptoms and half of the new cases had unremarkable duodenal mucosa. At least 10% of new cases of celiac disease are likely to be undiagnosed at routine upper endoscopy, particularly patients over 60 years who more commonly present atypically. All new CD patients could be identified in this study by performing pre-operative celiac antibody testing on all patients presenting for OGD and proceeding to biopsy only positive antibody patients and those presenting with either Major CI or abnormal duodenal mucosa for an estimated cost of AUS$4,629 and AUS$3,710 respectively.
Resource: PLOS ONE, March 2014, Vol 9, Issue 3 (www.plosone.org)

Celiac disease: diagnosis and management.
Abstract
Celiac disease is an autoimmune disorder of the gastrointestinal tract. It is triggered by exposure to dietary gluten in genetically susceptible individuals. Gluten is a storage protein in wheat, rye, and barley, which are staples in many American diets. Celiac disease is characterized by chronic inflammation of the small intestinal mucosa, which leads to atrophy of the small intestinal villi and subsequent malabsorption. The condition may develop at any age. Intestinal manifestations include diarrhea and weight loss. Common extraintestinal manifestations include iron deficiency anemia, decreased bone mineral density, and neuropathy. Most cases of celiac disease are diagnosed in persons with extraintestinal manifestations. The presence of dermatitis herpetiformis is pathognomonic for celiac disease. Diagnosis is supported by a positive tissue transglutaminase serologic test but, in general, should be confirmed by a small bowel biopsy showing the characteristic histology associated with celiac disease. The presence of human leukocyte antigen alleles DQ2, DQ8, or both is essential for the development of celiac disease, and can be a useful genetic test in select instances. Treatment of celiac disease is a gluten-free diet. Dietary education should focus on identifying hidden sources of gluten, planning balanced meals, reading labels, food shopping, dining out, and dining during travel. About 5% of patients with celiac disease are refractory to a gluten-free diet. These patients should be referred to a gastroenterologist for reconsideration of the diagnosis or for aggressive treatment of refractory celiac disease, which may involve corticosteroids and immunomodulators.
Resource: Am Fam Physician. 2014 Jan 15;89(2):99-105.
Celiac disease is an autoimmune disorder of the gastrointestinal tract. It is triggered by exposure to dietary gluten in genetically susceptible individuals. Gluten is a storage protein in wheat, rye, and barley, which are staples in many American diets. Celiac disease is characterized by chronic inflammation of the small intestinal mucosa, which leads to atrophy of the small intestinal villi and subsequent malabsorption. The condition may develop at any age. Intestinal manifestations include diarrhea and weight loss. Common extraintestinal manifestations include iron deficiency anemia, decreased bone mineral density, and neuropathy. Most cases of celiac disease are diagnosed in persons with extraintestinal manifestations. The presence of dermatitis herpetiformis is pathognomonic for celiac disease. Diagnosis is supported by a positive tissue transglutaminase serologic test but, in general, should be confirmed by a small bowel biopsy showing the characteristic histology associated with celiac disease. The presence of human leukocyte antigen alleles DQ2, DQ8, or both is essential for the development of celiac disease, and can be a useful genetic test in select instances. Treatment of celiac disease is a gluten-free diet. Dietary education should focus on identifying hidden sources of gluten, planning balanced meals, reading labels, food shopping, dining out, and dining during travel. About 5% of patients with celiac disease are refractory to a gluten-free diet. These patients should be referred to a gastroenterologist for reconsideration of the diagnosis or for aggressive treatment of refractory celiac disease, which may involve corticosteroids and immunomodulators.
Resource: Am Fam Physician. 2014 Jan 15;89(2):99-105.

A Retrospective Application of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition Guidelines for Diagnosis of Coeliac Disease in New Zealand Children.
In 2012 the European Society for Pediatric Gastroenterology, Hepatolog...

Coeliac disease: The debate on coeliac disease screening - are we there yet?
The majority of patients with coeliac disease are undiagnosed, leading...

Diagnosis and management of adult coeliac disease: guidelines from the British Society of Gastroenterology
ABSTRACT
A multidisciplinary panel of 18 physicians and 3 non-physi...

Serological Assessment for Celiac Disease in IgA Deficient Adults
Abstract
Purpose: Selective immunoglobulin A deficiency is the most...

Coeliac Patients Are Undiagnosed at Routine Upper Endoscopy
Abstract
Background and Aims
Two out of three patients with Coelia...

Celiac disease: diagnosis and management.
Abstract
Celiac disease is an autoimmune disorder of the gastrointe...
www.drschaer-institute.com
